MAPEANDO EL DOLOR
Aunque el dolor es una experiencia subjetiva, desde el siglo XIX se ha hecho evidente la necesidad de medir el dolor. Sin embargo, fue hasta principios de la década del 40 del siglo XX cuando un grupo de la Universidad de Connell, conformado por Hardy, Wolff y Goodell, comenzó a trabajar oficialmente en la elaboración de un método para medir la intensidad del dolor. Esta búsqueda estaba motivada por el cambio del concepto del dolor, que ahora incluía las vías neurológicas, los receptores periféricos y los centros cerebrales. De modo que el primer paso de los investigadores fue la creación de un dispositivo que producía un estímulo doloroso sobre la piel, llamado dolorímetro. Luego, crearon un sistema de puntuación para medir la intensidad del dolor experimentado.1-3
Paralelamente, tras la Segunda Guerra Mundial, Keele realizó estudios psicofisiológicos que permitieron entender mejor las técnicas utilizadas en la medición del dolor y proponer las primeras escalas, que fueron publicadas en 1948. Posteriormente, en 1953, John Bonica, conocido como el padre del estudio del dolor, publicó el primer libro que estudia a profundidad el tema. La historia continúa con Beeche, quien en 1959, al describir por primera vez el efecto placebo, identificó las variables que permiten calificar el dolor clínico con base en las respuestas subjetivas del paciente.1, 2
A mediados de la década del 60, dos psiquiatras del Reino Unido, Michael Bond e Issy Pilowsky, propusieron la escala analógica visual (EVA). No obstante, dado que la EVA se utilizó inicialmente solo para evaluar estados de ánimo, en 1974, Bond y Lader la introdujeron como una escala para medir el dolor debido a su alta sensibilidad y validez.2, 3
Por esa misma época, Ronald Melzack y Warren Torgerson idearon una escala verbal de 5 puntos, que incluía un espectro de leve a insoportable. Además, crearon una serie de palabras descriptivas con el fin de establecer un lenguaje propio del dolor, es decir, una terminología unificada que se pudiera utilizar en todos los entornos clínicos. A partir de estas palabras, en 1975, Melzack creó el cuestionario del dolor de McGill, una herramienta que se volvió fundamental en el estudio del dolor.3
Desde la consolidación de estas escalas en los 70 han surgido otras, como la numérica análoga de dolor (ENA), publicada por Downie en 1978, y otras que permiten mapear el dolor teniendo siempre como base la percepción del paciente, quien es el que mejor conoce su dolor.2
Referencias
1. Serrano-Artero MS, Caballero J, Cañas A, et al. Valoración del dolor (I). Rev. Soc. Esp. Dolor. 2002;9:94-108. 2. González-Estavillo AC, Jiménez-Ramos A, Rojas-Zarco EM. Correlación entre las escalas unidimensionales utilizadas en la medición de dolor postoperatorio. Revista Mexicana de Anestesiología. 2018;41(1):7-14. 3. Ball C, Westhorpe RN. The history of pain measurement. Anaesthesia and Intensive Care. 2011;39(4):529.
Caso de un Paciente con Vértigo
“Me preocupa no poder volver a conducir solo” Michael, 58 años
DIAGNÓSTICO: vértigo vestibular de origen desconocido,
Este es Michael, tiene 58 años, parece gozar de excelente salud y se desplaza al trabajo en su automóvil. En los últimos dos meses, ha experimentado episodios en los que se ha sentido extremadamente mareado hasta el punto de empezar a entrar en pánico. Los tratamientos anteriores le han dado sueño. Su médico ha identificado que padece vértigo vestibular de origen desconocido.
¿PODRÍA LA BETAHISTINA SER LA OPCIÓN CORRECTA PARA MICHAEL?
Los estudios clínicos diseñados específicamente para investigar la capacidad de conducir han demostrado que la betahistina tiene un efecto nulo o insignificante.1 A diferencia de otros medicamentos utilizados para tratar el vértigo, se considera comúnmente que la betahistina no causa sedación en dosis terapéuticas.2,3
¿CUÁL ES EL EFECTO DE LA BETAHISTINA EN LA COMPENSACIÓN VESTIBULAR?
Los efectos incapacitantes para los pacientes de vestibular mejoran con la recuperación funcional espontánea a través del proceso de compensación vestibular.1
LA BETAHISTINA FACILITA LA COMPENSATION2 VESTIBULAR
Evaluación del paciente de la mejora de la estabilidad postural tras la neurotomía vestibular unilateral*
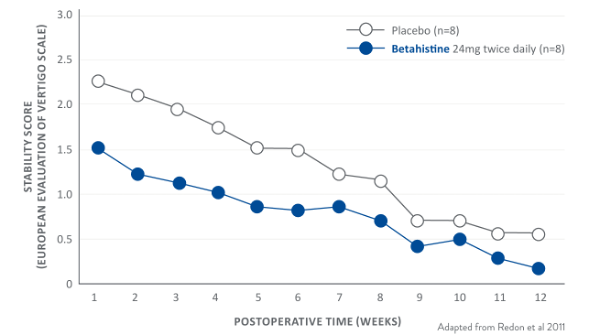
BETAHISTINA 48 MG / DÍA MEJORÓ LA ESTABILIDAD POSTURAL EN 7 DIAS, QUE ES SOLO 4 DÍAS DESPUÉS DE QUE EL TRATAMIENTO EMPEZARÁ4
LA RECONFORTANTE VOZ DEL ALIVIO
LA ESCALA ANALGÉSICA DE LA EMPATÍA Y LA ESCUCHA
Me quedé anclada a la silla. Después de una jornada laboral muy ocupada, en la que tuve que estar la mayor parte del tiempo sentada, el dolor en la zona lumbar casi no me deja levantar. Luego, en los días siguientes, el dolor se volvió cada vez más intenso al punto de llevarme a tomar analgésicos tres veces al día. Antes de consultar con el médico me enteré de que el dolor lumbar es la principal causa de discapacidad en todo el mundo y que está fuertemente vinculado con la pérdida de funcionalidad. Sin embargo, cuando asistí a la consulta, la indicación fue continuar con los analgésicos por un par de semanas más y tratar de hacer pausas activas. No hubo tiempo para que yo expresara el temor que me producía la posibilidad de perder mi empleo por causa del dolor.1
Pasaron más de seis meses entre radiografías, sentarme en un cojín inflable e ir y venir de un analgésico a otro, pero el dolor no cedía, por el contrario, ya no me dejaba dormir bien y no soportaba estar sentada por más de 15 minutos. Fue entonces cuando, en una nueva consulta, el médico me explicó que para reducir el impacto del dolor y mejorar la funcionalidad y la calidad de vida es necesario que el tratamiento esté enfocado en el paciente, no en el síntoma que es el dolor. Al hacerme preguntas acerca de lo que esperaba del tratamiento, de cómo me sentía con los analgésicos, del nivel de angustia que me producía el dolor y de las actividades que me gustaría volver a realizar, por primera vez me sentí escuchada y pude describir cómo percibía la afectación que el dolor lumbar causaba en varios aspectos de mi vida, no solo en el laboral. Si bien nunca llegué a tener depresión, el dolor sí me estaba llevando al aislamiento social.2
Todo esto me sirvió para entender que la experiencia del dolor es multidimensional y que yo, como paciente, debía asumir un papel más activo en las decisiones de mi propio tratamiento. Después de comprender que la causa del dolor no es solamente física, sino que en su desarrollo y cronificación intervienen la genética, el entorno social, los miedos y expectativas, los resultados de otros tratamientos realizados previamente, la edad y el uso de opioides a largo plazo, mi perspectiva cambió completamente.2, 3 Con base en mi experiencia, como una mujer de 52 años con un dolor lumbar crónico, hoy puedo decir que el tratamiento efectivo del dolor empieza por la empatía y la escucha. Solo cuando me hicieron una evaluación que indagaba por todas las condiciones físicas, emocionales y sociales presentes en mi vida, pude identificar que mi dolor no cedía por causa del estrés y la angustia. Estaba en un círculo vicioso de emociones, postura corporal y presión laboral. Pero el abordaje multidisciplinario y multimodal me ayudó a tener una visión más amplia del dolor, a manejarlo y a recuperar mi funcionalidad.3
Referencias
1. Benz T, Lehmann S, Elfering A, et al. Comprehensiveness and validity of a multidimensional assessment in patients with chronic low back pain: a prospective cohort study. BMC Musculoskelet Disord. 2021;22(1):291. 2. Langford DJ, Tauben DJ, Sturgeon JA, et al. Treat the Patient, Not the Pain: Using a Multidimensional Assessment Tool to Facilitate Patient-Centered Chronic Pain Care. J Gen Intern Med. 2018;33(8):1235-1238. 3. Blanco E, Chavarría G, Garita Y. Manejo multimodal del dolor crónico. Revista Médica Sinergia. 2021;6(4):e625.
LAS MÁSCARAS DEL DOLOR
El complejo fenómeno del dolor está mediado tanto por causas físicas como psicológicas y, aunque puede existir dolor psicógeno sin dolor físico, el dolor psicógeno siempre acompaña al dolor físico. Por lo tanto, la experiencia integral del dolor es psíquica, independiente del origen. Así las cosas, a medida que un paciente centra cada vez más la atención en su sensación de dolor, la percepción de la intensidad puede aumentar, situación que lo lleva a presentar quejas que ante los profesionales de salud pueden resultar irracionales, pero que ocultan factores genuinos.1,2 Ahora bien, en la definición del dolor psicógeno es preciso aclarar que, aunque está asociado a factores psicológicos, tiene un estatus diferente a la depresión, la ansiedad, la desesperanza, la ira y otras emociones. Sin embargo, algunos problemas emocionales pueden causar, aumentar o prolongar el dolor y, debido a que el cerebro es el centro que descifra los niveles y la localización del malestar, las personas que tienen un trastorno emocional subyacente tienen un mayor riesgo de presentar dolor psicógeno.2,3
LA DELGADA LÍNEA ENTRE EL DOLOR PSICÓGENO Y EL DOLOR FÍSICO
¿Cómo tener la certeza de que el origen del terrible dolor que refiere el paciente está totalmente en su mente? Más aún, ¿cómo evaluar a alguien que puede tener una lesión orgánica con solapamiento psicógeno? Para responder adecuadamente a estos desafíos de la práctica clínica no hay una respuesta infalible, por lo que la mezcla de paciencia con experiencia será la guía.1
De acuerdo con las imágenes cerebrales, los límites entre el dolor físico y el dolor psicógeno son difusos puesto que hay una sobreposición de las estructuras involucradas en ambos. En efecto, el dolor psicógeno activa varias de las estructuras nociceptivas del cerebro que también se observan en el dolor físico, como algunas áreas de la circunvolución cingulada anterior, la circunvolución frontal 6 inferior, la ínsula, el tálamo y la sustancia gris periacueductal del tronco cerebral. Así mismo, se han identificado otras áreas afectadas, relacionadas con la recompensa y la motivación, entre las que se encuentran el núcleo accumbens y la sustancia gris ventrotegmental.2
No obstante, en la práctica real es importante diferenciar el dolor de la angustia emocional y no desestimar el dolor psicógeno como si este no fuera real. Los dos son tipos de dolor real y pueden provocar un gran sufrimiento.4
Ante la queja de un paciente, no se puede dudar de que su dolor es biológicamente real en tanto que todos los pensamientos y sentimientos tienen una base neurofisiológica. El reto no es identificar el límite entre un tipo de dolor u otro, sino encontrar una manera eficiente de responder ante ese dolor. Por ejemplo, si un paciente, cuyo dolor es la máscara de un reclamo de indemnización por una herida emocional irresuelta, sigue un tratamientoanalgésico convencional, es muy probable que al cabo de unas pocas semanas refiera que los síntomas no han mejorado o han empeorado, y esto no solamente es desalentador para el médico, sino que afecta el estado mental del paciente. Pero, por otro lado, el hecho de que un tratamiento no tenga éxito no significa que el dolor sea meramente psicógeno.1,4
EL DESAFÍO DEL DIAGNÓSTICO Y EL TRATAMIENTO
En el diagnóstico del dolor psicógeno es fundamental tener en cuenta la coherencia entre la descripción que hace el paciente y la evaluación física. Las suposiciones sobre posibles factores psicológicos, como ansiedad, depresión, vida estresante o insatisfacción familiar no pueden ser la base del diagnóstico, pues la concentración en los aspectos emocionales puede hacer perder de vista una causa física que, de hecho, exista.1
Frente a un dolor que se ha vuelto crónico, es importante aplicar estrategias para gestionar la angustia antes de que se desencadenen situaciones más complejas como la desesperanza o incluso la ideación suicida. En este punto, es necesario mostrarles a los pacientes que pedir ayuda psicológica no es estigmatizante, no minimiza la experiencia del dolor que está viviendo y no significa que el médico crea que el dolor es imaginario.3
Involucrar al paciente en su plan de tratamiento, fijando objetivos realistas en conjunto y estableciendo una comunicación abierta que le permita sentir confianza es el primer paso para encontrar un alivio que contemple lo físico y lo psíquico.3
Referencias
1. Psychogenic pain. Orthopaedic medicine and psychogenic pain. Elsevier. 2013:e320-e326. 2. Méndez JC. Dolor psíquico: una mirada a su condición actual. Rev Chil NeuRo-Psiquiat. 2019;57(2):176-182. 3. Chhabria A. Psychogenic Pain Disorder – Differential Diagnosis and Treatment. J Assoc Physicians India. 2015;63(2 Suppl):36-40. 4. Seminowicz D, Pustilnik A, Gioioso MK, et al. Haythornthwaite, & Tor D. Wager, Panel 3: Chronic Pain, “Psychogenic” Pain, and Emotion, 18 J. Health Care L. & Pol’y 275 (2015). Available at: http:// digitalcommons.law.umaryland.edu/jhclp/vol18/iss2/5
EL ALIVIO EN EL TELÉFONO MÓVIL
En Colombia, el dolor crónico hace parte de las cinco condiciones que generan una mayor carga al sistema de salud, pues representa el 4,5% de la carga total de enfermedad en el país, con un total de más de cinco millones de pacientes con dolor crónico, lo que quiere decir que cerca del 11% de la población padece esta condición, de acuerdo con los datos arrojados por el más reciente estudio de carga de la enfermedad, en el que también se revela que el dolor lumbar, la artrosis y el dolor relacionado con el cáncer son los grupos de dolor más importantes.1
Estos datos dejan al descubierto la necesidad de implementar estrategias que puedan disminuir la carga, tanto del sistema en general como del paciente individual. En este sentido, es clave la educación, ya que, teniendo en cuenta un modelo asistencial centrado en el paciente, es fundamental incentivar acciones que lo incluyan en las decisiones que tienen que ver con su tratamiento. Por lo tanto, el uso de herramientas digitales que apoyen la evaluación subjetiva y el manejo del dolor de una manera cuantificable puede contribuir a mejorar la atención y la experiencia del paciente en el alivio del dolor.2
Durante los últimos años han surgido alternativas innovadoras para apoyar la autogestión de los pacientes con dolor crónico. Una de ellas es la atención en salud basada en dispositivos móviles, más conocida como salud móvil. Los objetivos de esta estrategia se centran en la educación, brindando información general sobre el dolor, la identificación de los síntomas y la planificación del tratamiento; la monitorización, es decir, hacer un seguimiento de los episodios diarios de dolor y su intensidad, el estado de ánimo, la actividad y el uso de medicación; y el tratamiento, que incluye varias estrategias de gestión.3 Según una revisión sistemática de los efectos de las intervenciones de salud móvil sobre la intensidad del dolor, la calidad de vida y la discapacidad funcional, algunas de las aplicaciones móviles diseñadas para tal fin tienen efectos beneficiosos en la reducción del dolor, principalmente en dolor cervical crónico, f ibromialgia, cistitis intersticial/síndrome de vejiga dolorosa y osteoartritis. En cuanto a la calidad de vida, los mayores beneficios se obtienen en dolor lumbar crónico, dolor cervical crónico, síndrome de intestino irritable y osteoartritis. Así mismo, la discapacidad funcional mejora notablemente en dolor lumbar crónico, dolor musculoesquelético crónico, dolor cervical crónico y osteoartritis. En suma, la evidencia científica sugiere que la salud móvil puede ser una alternativa de gran ayuda en el manejo del dolor crónico por medio de enfoques multimodales.3
Referencias
1. Lasalvia P, Gil-Rojas Y, Rosselli D. Burden of disease of chronic pain in Colombia. Expert Rev Pharmacoecon Outcomes Res. 2022;22(8):1261-1267.
2. Koumpouros Y, Georgoulas A. Pain Management Mobile Applications: A Systematic Review of Commercial and Research Efforts. Sensors (Basel). 2023;23(15):6965.
3. Moreno-Ligero M, Moral-Munoz JA, Salazar A, et al. mHealth Intervention for Improving Pain, Quality of Life, and Functional Disability in Patients With Chronic Pain: Systematic Review. JMIR Mhealth Uhealth. 2023;11:e40844.
UN EVALUADOR INTELIGENTE E IMPARCIAL DEL DOLOR
Conozca la nueva innovación en el campo del Dolor:
La evaluación precisa del dolor es una tarea retadora debido a los múltiples elementos que intervienen en la experiencia de cada persona, como los factores emocionales, el estilo de vida, los componentes conductuales y la capacidad subjetiva para afrontar el dolor, además de algunas condiciones que pueden dificultar aún más dicha evaluación, como sucede con los pacientes que presentan dificultades de comunicación. 1
En la práctica, una evaluación inexacta conduce a un manejo inadecuado del dolor que, a su vez, trae como consecuencia un aumento del uso de los servicios de salud, las hospitalizaciones, las visitas a urgencias, el aumento del riesgo de abuso de opiáceos y una carga económica significativa. Por ello, con el fin de mejorar los resultados de los pacientes, la inteligencia artificial, entendida como una herramienta que aplica soluciones novedosas para resolver retos complejos, ha empezado a desempeñar un papel cada vez más relevante para reconocer, evaluar, comprender y tratar el dolor.2
CUANDO NO HAY PALABRAS PARA DESCRIBIR EL DOLOR, LA INTELIGENCIA ARTIFICIAL HACE LA EVALUACIÓN.
En las distintas situaciones clínicas en las que un paciente no puede expresar a través del habla cuánto dolor siente, las expresiones faciales se convierten en el punto de partida para encaminar el tratamiento. Sin embargo, las escalas de evaluación no verbales demandan una gran cantidad de tiempo y la subjetividad en la interpretación de los gestos del paciente puede llevar a una decisión equivocada en cuanto al manejo.3
Por lo tanto, la investigación actual se está centrando en el entrenamiento de modelos de inteligencia artificial que sean capaces de hacer la evaluación. Entre las propuestas realizadas, se encuentra un algoritmo que interpreta imágenes de los rostros de los pacientes para identificar si tienen dolor.3
Ahora bien, para determinar la efectividad de la inteligencia artificial, los investigadores compararon sus resultados con los arrojados por una herramienta de observación del dolor, llamada Critical Care Pain Observation Tool (CPOT), y encontraron que, en relación con la CPOT, las lecturas de la inteligencia artificial tenían una precisión del 88%, lo cual marca un camino prometedor, sin perder de vista la importancia de incluir más variables y de no caer en la subestimación del dolor.3
El hecho de que la inteligencia artificial pueda hacer una evaluación confiable sobre cómo y cuándo las personas sienten dolor, con base en el uso de la expresión facial como biomarcador, abre la puerta para realizar estudios de modulación del dolor, que son muy complejos de llevar a cabo con observadores humanos.3
LA INTELIGENCIA ARTIFICIAL EN LA PREDICCIÓN Y EL MANEJO DEL DOLOR POSOPERATORIO
La investigación ha demostrado que el enfoque de aprendizaje automático, un subconjunto de la inteligencia artificial, puede utilizarse para seleccionar preguntas clave en un cuestionario de dolor, lo que permite predecir, con una precisión relativamente alta, cómo será la persistencia del dolor. Esto significa que la inteligencia artificial podría mejorar el manejo del dolor al ofrecer estrategias más personalizadas y eficaces, adaptadas a las necesidades particulares de cada paciente.2,4
Teniendo en cuenta que, además de aliviar el dolor, el objetivo es lograr una recuperación rápida, minimizar los efectos secundarios de los fármacos y optimizar la calidad de vida del paciente, la inteligencia artificial tiene el potencial de personalizar el manejo del dolor a través del análisis de datos, como el tipo de medicación utilizado, las cirugías previas y otros factores relevantes de la historia clínica. Así las cosas, los médicos tienen la posibilidad de personalizar los tratamientos analgésicos, de tal manera que los pacientes reciban la dosis adecuada en el momento indicado, lo que evita tanto la sobremedicación como el alivio ineficaz del dolor.4 Además, por otra parte, los dispositivos de monitoreo con inteligencia artificial incorporada se proyectan como una gran herramienta para seguir la progresión del dolor en tiempo real, de manera que se pueda ajustar la medicación en el momento preciso que se requiera.4
Referencias
1. Cascella M, Schiavo D, Cuomo A, et al. Artificial Intelligence for Automatic Pain Assessment: Research Methods and Perspectives. Pain Res Manag. 2023;2023:6018736.
2. Zhang M, Zhu L, Lin SY, et al. Using artificial intelligence to improve pain assessment and pain management: a scoping review. J Am Med Inform Assoc. 2023;30(3):570-587.
3. Remaly J. La inteligencia artificial “ve” cuando los pacientes sienten dolor [Internet]. Medscape; 2023. Disponible en: https://n9.cl/7s4ds
4. Montero F, Barzallo L. Aplicación de la inteligencia artificial en la gestión del dolor en pacientes postoperatorios: revisión bibliográfica. Salud ConCiencia. 2023;2(2):e22
Etoricoxib para el alivio de la inflamación
ETORICOXIB
Los procedimientos quirúrgicos causan inevitablemente heridas, dolor posoperatorio (POP) y sangrado perioperatorio. La Organización Mundial de la Salud (OMS) ha indicado el uso de fármacos como acetaminofén, antiinflamatorios no esteroideos (AINE) y opioides como medida terapéutica de estas afecciones, siendo los AINE ampliamente recomendados por su acción antiinflamatoria y analgésica. En el siguiente QR veremos los beneficios en cuanto a seguridad de los inhibidores de la COX-2 selectivos en los pacientes con dolor POP
La osteoartritis es una de las principales causas de morbilidad y discapacidad en todo el mundo, que por su naturaleza crónica como objetivos de tratamiento pretende modular el dolor, mejorar la funcionalidad y reducir la discapacidad del paciente; el analgésico oportuno para lograr esos objetivos terapéuticos en el paciente es el Etoricoxib. Lo invitamos a escanear el QR para ver el video en el que conversamos a la luz de la evidencia científica sobre el uso de Etoricoxib en dolor crónico
Manejar el dolor crónico en ocasiones es todo un desafío, por lo que se hacen necesarios analgésicos que tengan una eficacia sostenida en el tiempo, que en patologías como osteoartritis tengan un efecto tanto analgésico como antiinflamatorio y que, además, tengan un buen perfil de seguridad. lo invitamos a escanear el QR para descubrir en este video el analgésico que le confiere todos estos beneficios. Lograr la modulación del dolor agudo de su paciente lo más pronto posible y con el adecuado perfil de seguridad gastrointestinal, le brindará al paciente una recuperación en bienestar. Lo invitamos ver el siguiente video para profundizar en este tema.
Hidrocodona vs tramadol: mecanismos
Hidrocodona:

Hidrocona es un opioide relativamente potente para el control del dolor de intensidad moderada a severa en pacientes posoperatorios, pacientes con trauma y pacientes oncológicos.
Hidrocodona es un agonista completo de opioides que interactúa con el receptor mu y, en menor medida, con los receptores delta. Al activarse, los receptores mu-opioides llevan a la inhibición de los reflejos del dolor nociceptivo e inducen una analgesia profunda sin afectar otras modalidades sensoriales como el tacto; además, los receptores opioides activados inhiben la liberación de neurotransmisores, incluyendo la sustancia P.
Tramadol:

Tramadol, por su parte, posee una unión de baja afinidad al receptor mu-opioide, lo cual limita en parte su efectividad en el tratamiento del dolor agudo.2 Tramadol, además, no posee acción anti-prostaglandina.
Algunos estudios han mostrado que el tramadol proporciona un nivel de analgesia inferior y un perfil de tolerabilidad menos deseable comparado con otros antiinflamatorios no esteroideos en el manejo del dolor posoperatorio.
Seguridad: Efectos adversos (EA) reportados

En un estudio realizado por Rauck y cols., muchos de los pacientes incluidos encontraron un alivio efectivo del dolor a 200 mg/d de tramadol, pero otros requirieron dosis de hasta 400 mg/d. En ese estudio, el 19% de los pacientes que tomaban tramadol interrumpieron el tratamiento debido a eventos adversos, el 12% debido a síntomas gastrointestinales.
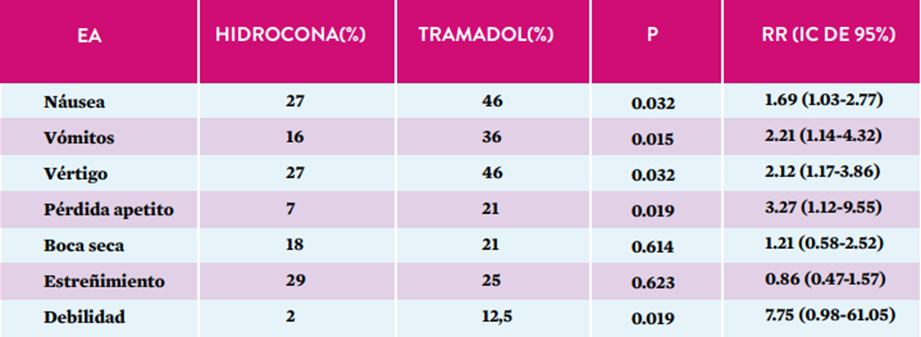
En un estudio realizado por Rodríguez y cols., se reportaron los EA, en ambos grupos (tramadol versus hidrocodona), que se muestran en la tabla
Principios de equivalencia analgésica
Hidrocona
La potencia relativa de HIDROCODONA en relación con otros opioides no se ha estudiado completamente; se basa más bien en la práctica clínica y el conocimiento empírico. La hidrocodona no está incluida en la tabla de dosis equianalgésica original. En aquellas tablas donde se incluye siempre se considera una relación 1:1 con morfina oral. En estas tablas, se pueden observar pares de dosis equianalgésicas tales como 20-30 mg de morfina oral equivalentes a 20-30 de hidrocodona oral, 30 mg de morfina oral equivalente a 30-45 mg de hidrocodona oral, o 30 mg de morfina oral equianalgésicos a 30 mg de hidrocodona oral. A pesar de las importantes limitaciones de la evidencia disponible, las recomendaciones son lo suficientemente consistentes para determinar una proporción 1:1 con respecto a la morfina oral.
Tramadol
Por su parte, de manera muy consistente se ha encontrado que la potencia relativa de la morfina parenteral con respecto al tramadol parenteral es 1:10 a 1:11, y la recomendación más repetida y utilizada es 1:10. Algunas tablas recomiendan esta misma proporción 1:10 al convertir las dosis entre morfina y tramadol orales. La biodisponibilidad del tramadol oral (80% a 100%), sin embargo, es mucho más alta que la de la morfina oral (30% a 50%), por lo que mantener la proporción 1:10 sería erróneo. En los estudios de rotación de opioides, las proporciones finales se encontraron entre 1: 3,8 y 1: 5,3. Existen muchas tablas que recomiendan una relación 1:5 entre la morfina y el tramadol orales, pero no provienen de estudios clínicos.
Hidrocodona muestra un mejor perfil de farmacodinamia, efectividad equianalgésica y un mejor perfil de seguridad que tramadol.
Referencias
1. Habibi M, Kim PY. Hydrocodone and Acetaminophen. In: StatPearls. StatPearls Publishing; 2021. Accessed April 23, 2021. http://www.ncbi.nlm.nih.gov/books/NBK538530/
2. Turturro MA, Paris PM, Larkin GL. Tramadol versus hydrocodone-acetaminophen in acute musculoskeletal pain: a randomized, double-blind clinical trial. Ann Emerg Med. 1998;32(2):139-143. doi:10.1016/s0196-0644(98)70127-1
3. Hernández-Ortiz A. Construction of a nomogram to facilitate the calculation of equianalgesic doses for opioid rotation. 2016;39(4):10.
4. Rauck RL, Ruo GE, McMillen JI. Comparison of tramadol and acetaminophen with codeine for long-term pain management in elderly patients. Curr Ther Res. 1994;55(12):1417-1431. doi:10.1016/S0011-393X(05)80748-9
5. Rodriguez RF, Castillo JM, Castillo MP, et al. Hydrocodone/Acetaminophen and Tramadol Chlorhydrate Combination Tablets for the Management of Chronic Cancer Pain: A Double-blind Comparative Trial. Clin J Pain. 2008;24(1):1-4. doi:10.1097/AJP.0b013e318156ca4d
Masajes y técnicas efectivas para la prevención y manejo de contracturas
Contractura ¿Qué son?
Las contracturas se pueden definir como un encogimiento permanente en los músculos, los tendones, la piel y los tejidos cercanos, los cuales provocan que las articulaciones se acorten y se vuelvan rígidas. En ocasiones, esta afectación también provoca la pérdida de elasticidad y, en casos extremos, una deformación en las articulaciones.
Automasaje: ¿Por qué automasajearse?
Con los automasajes se pueden aliviar muchos problemas, desde reducir el estrés, disminuir considerablemente el dolor en la zona afectada, hasta mejorar el flujo sanguíneo local. Algunos de los beneficios principales del masaje son la relajación, el tratamiento de la condición muscular de dolor que se presenta, y además la reducción de la ansiedad. Profesionales en la salud aseguran que el masaje produce mejoras a corto plazo en factores como el trastorno del sueño y del dolor.

Técnicas y pasos para los automasajes
El foam rolling es una técnica que requiere contacto directo con la piel, donde se ejerce una fuerza controlada con un rodillo de espuma que se denomina foam roller, el cual presiona lentamente sobre la zona de dolor muscular.
Algunos estudios indican que esta herramienta tiene beneficios como:

Mejora la amplitud en el movimiento de las articulaciones.
Disminuye los efectos del dolor muscular agudo y ayuda al proceso de recuperación de la zona afectada.
Aumenta el rendimiento muscular durante y después del ejercicio.
En general, el masaje manual requiere de la intervención de un fisioterapeuta o especialista, mientras que el foam rolling es una técnica que se puede practicar de maneraautónoma.
Algunos de los ejercicios para usar el foam rolling son:
Realizar movimientos sencillos de ida y vuelta, efectuando fuerza sobre los tejidos blandos por medio del peso del cuerpo.
Ejercer una fuerza o presión estática durante 6 a 30 segundos sobre la zona afectada Esto quiere decir que, en vez de rodar el aparato por todo el músculo, se ejerce presión sobre el punto de dolor manteniéndose en la misma posición
Referencias
1. Lieber RL, Fridén J. Muscle contracture and passive mechanics in cerebral palsy. J Appl Physiol (1985). 2019;126(5):1492-1501.
2. Mayo Clinic. Masajes: conoce todo sus beneficios. [Internet]. [Lugar desconocido]: mayoclinic.org; 2021. [Acceso el 11 de enero de 2022]. Disponible en: https://www.mayoclinic.org/es-es/healthy-lifestyle/stress-management/in- depth/ massage/art-20045743
3. Vickers A, Zollman C, Reinish JT. Massage therapies. West J Med. 2001; 175(3):202–204.
4. Kerautret Y, Di Rienzo F, Eyssautier C, Guillot A. Selective Effects of Manual Massage and Foam Rolling on Perceived Recovery and Performance: Current Knowledge and Future Directions Toward Robotic Massages. Front Physiol. 21 de diciembre de 2020;11:598898.
5. Cheatham SW, Kolber MJ, Cain M, Lee M. The Effects Of Self-myofascial Release Using A Foam Roll Or Roller Massager On Joint Range Of Motion, Muscle Recovery, And Performance: A Systematic Review. Int J Sports Phys Ther. Noviembre De 2015;10(6):827-38.
Cronificación del dolor debido a mal manejo del dolor agudo
Panorama de la cronificación en dolor en casos puntuales
El mejor predictor de cervicalgia futura es la presencia de un episodio de cervicalgia en el pasado.1
La cervicalgia aguda usualmente se resuelve hacia los dos primeros meses desde el episodio inicial, sin embargo, una proporción significativa de pacientes continúan presentando recurrencias del dolor o algún grado de malestar asociado después de un año.1
Algunos factores de cronicidad incluyen el estrés psicosocial, el estilo de vida sedentario, las cefaleas, el género femenino, el aumento secundario del dolor, las deficiencias ergonómicas y el pobre ambiente físico laboral.1

En cualquier caso, el tratamiento apropiado de los episodios agudos de estos tipos de dolor mecánico puede disminuir la probabilidad de que los pacientes desarrollen dolor crónico, un síntoma comúnmente difícil de mitigar.1
MANEJO AGUDO ADECUADO: ELEMENTOS DE PREVENCIÓN FUNDAMENTALES PARA CRONIFICACIÓN
El control del dolor crónico es usualmente difícil.2
- Estudios en humanos y animales indican que algunas de las alteraciones de neuroplasticidad (sensibilización medular) después del trauma pueden ser prevenidas por medio del tratamiento agresivo del dolor agudo.2
- La analgesia multimodal con combinaciones de fármacos que tienen diferentes mecanismos de acción y efectos aditivos o sinérgicos parecen interferir adecuadamente con la complejidad de la transmisión del dolor.2
- La asociación de fármacos, además de contemplar las diversas dianas inhibitorias de la fisiopatología del dolor, también promueve reducciones significativas de sus efectos adversos al disminuir las dosis necesarias.2
- En el caso de los opioides, se produce una disminución entre un 20% y un 40% de los efectos no deseados, especialmente de náuseas, vómitos y sedación.2
- El manejo farmacológico analgésico oportuno y adecuado con combinaciones como acetaminofén / hidrocodona, puede prevenir la cronificación del dolor, el cual implica fuertes dificultades de remisión o reversión.3,4
Referencias:
- Popescu A, Lee H. Neck Pain and Lower Back Pain. Med Clin North Am. 2020;104 (2):279-292. doi:10.1016/j.mcna.2019.11.003
- Kraychete DC, Sakata RK, Lannes L de OC, Bandeira ID, Sadatsune EJ. Dor crônica persistente pós operatória: o que sabemos sobre prevenção, fatores de risco e tratamento? Braz J Anesthesiol. 2016;66(5):505-512. doi:10.1016/j.bjan.2014.12.002
- Chang AK, Bijur PE, Lupow JB, Gallagher EJ. Comparative Analgesic Efcacy of Oxycodone/Acetaminophen vs Codeine/Acetaminophen for Short-Term Pain Management Following ED Discharge. Pain Med. 2015 Dec;16(12):2397- 404. doi: 10.1111/pme.12830. Epub 2015 Jul 14. PMID: 26176973.
- Montero Matamala A, Hanna M, Perrot S, Varrassi G. Avoid Postoperative Pain To Prevent Its Chronification: A Narrative Review. Cureus. 2022 Feb 15;14(2):e22243. doi: 10.7759/cureus.22243. PMID: 35340463; PMCID: PMC8930466