¿Qué es colesterol remanente? – Dr Carlos Mendivil
La sinfonía de la intimidad – Amanda Gooking.

Para mantener la sinfonía de la intimidad en equilibrio, es crucial adoptar hábitos saludables. Esto incluye mantener una buena higiene íntima, usar ropa interior de algodón, evitar duchas vaginales y productos perfumados, y tener una dieta equilibrada. También es importante acudir al ginecólogo regularmente para chequeos y tratamientos adecuados.1,2

Referencias
- Gonzalez, L. R. R. (2020, 16 diciembre). Infecciones vaginales: tipos, síntomas, causas y tratamientos. Muy Salud. https://muysalud.com/enfermedades/infecciones-vaginales-tipos-sintomas-causas-tratamientos/
- Médico, P. (2019, 31 diciembre). Infecciones vaginales: síntomas, tipos, causas y tratamiento. Policlínica Metropolitana. https://policlinicametropolitana.org/informacion-de-salud/infecciones-vaginales
Beneficios de ciproterona en el tratamiento del síndrome de ovario poliquístico (SOP)
El síndrome de ovario poliquístico (SOP) es el trastorno endocrino más frecuente que afecta a la mujer, con una prevalencia documentada entre el 2,2% y el 26,0% en mujeres en edad reproductiva. Este síndrome es un fenotipo heterogéneo con varias clasificaciones, en su mayoría caracterizado por ciclos anovulatorios, hiperandrogenismo y trastornos metabólicos. Aunque su patogenia no ha sido claramente identificada, los factores genéticos y de estilo de vida pueden causar el desarrollo de las principales características del SOP. 1,2

Básicamente, cuatro fenotipos están claramente definidos:3
- Hiperandrogenismo, oligo-/anovulación más morfología de ovario poliquístico.
- Hiperandrogenismo más oligo-/anovulación.
- Oligo-/anovulación más morfología de ovario poliquístico.
- Hiperandrogenismo más morfología de ovario poliquístico.
El hiperandrogenismo clínico y/o bioquímico, la distribución anormal de la grasa, la obesidad central y la resistencia a la insulina se observan en el 50% a 70% de los casos, y el síndrome metabólico, en aproximadamente el 40% de las pacientes con SOP.3
Riesgos y tratamientos
Cuando se comparan con la población general femenina, las mujeres con SOP muestran una mayor prevalencia de disglicemia, dislipidemia, síndrome metabólico, hipertensión y mayor riesgo de cáncer de endometrio. Así, los objetivos de la terapia en mujeres adultas con SOP que no buscan la fertilidad incluyen la mejoría de las molestias dermocosméticas hiperandrogénicas, la prevención de la hiperplasia endometrial/adenocarcinoma y la prevención o el tratamiento temprano de los trastornos cardiometabólicos. Estos objetivos pueden lograrse al abordar tanto el exceso de andrógenos como la resistencia a la insulina.4
La carga económica del SOP y sus secuelas asociadas a corto y largo plazo son difíciles de estimar con precisión debido a los desafíos históricos para definir el SOP y la posible subestimación del número de mujeres afectadas.5
Ciproterona: potente antiandrógeno en el manejo del sop
Ciproterona acetato, en combinación con etinilestradiol, es ampliamente utilizada en Europa y Canadá. Es un antiandrógeno esteroide (derivado de la 17-hidroxiprogesterona) que compite con la dihidrotestosterona por la unión al receptor de andrógenos, inhibiendo la actividad de la 5-alfareductasa. También resulta en una disminución de la producción de testosterona y androstenediona a través de una retroalimentación negativa en el eje hipotálamo-pituitario e inhibiendo la secreción de la hormona luteinizante. 6
Una revisión sistemática y metaanálisis de 2018 encontró que los anticonceptivos orales (AOC) que contienen acetato de ciproterona pueden suprimir eficazmente las gonadotropinas, lo que provoca una disminución de los parámetros androgénicos. Aunque diferentes productos de AOC podrían suprimir significativamente el perfil androgénico, los productos que contienen acetato de ciproterona resultaron ser más efectivos para suprimir los niveles de gonadotropina y estradiol en pacientes con SOP.7
Los síntomas cutáneos hiperandrogénicos relacionados con el SOP se tratan eficazmente con
ciproterona / etinilestradiol, lo que reduce no solo los síntomas sino también su impacto negativo en la calidad de vida y la salud mental. Los beneficios adicionales comprobados para estas pacientes incluyen el tratamiento de las irregularidades menstruales y la reducción del riesgo de cáncer de endometrio. Algunos posibles beneficios incluyen además la preservación de la fertilidad.5
Componente dermatológico de ciproterona en sop:
Los estudios han sugerido que ciproterona es efectiva para el tratamiento del hirsutismo y acné, y superior a placebo, desogestrel y drospirenona.1,6
Referencias
- Amiri M, Kabir A, Nahidi F, Shekofteh M, Ramezani Tehrani F. Effects of combined oral contraceptives on the clinical and biochemical parameters of hyperandrogenism in patients with polycystic ovary syndrome: a systematic review and meta-analysis. Eur J Contracept Reprod Health Care. 2018;23(1):64-77. doi:10.1080/13625187.2018.1435779
- Choi EJ, Yang YM. Efficacy and safety of metformin or oral contraceptives, or both in polycystic ovary syndrome. Ther Clin Risk Manag. Published online September 2015:1345. doi:10.2147/TCRM. S89737
- de Medeiros SF, Medeiros MAS de, Santos N de S, Barbosa BB, Yamamoto MMW. Combined Oral Contraceptive Effects on Low-Grade Chronic Inflammatory Mediators in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis. Int J Inflamm. 2018;2018: 1-13.doi:10.1155/2018/9591509
- Luque-Ramírez M, Nattero-Chávez L, Ortiz Flores AE, Escobar-Morreale HF. Combined oral contraceptives and/or antiandrogens versus insulin sensitizers for polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod Update. 2018;24(2):225-241. doi:10.1093/humupd/dmx039
- Ruan X, Kubba A, Aguilar A, Mueck AO. Use of cyproterone acetate/ethinylestradiol in polycystic ovary syndrome: rationale and practical aspects. Eur J Contracept Reprod Health Care. 2017;22(3):183-190. doi:10.1080/13625187.2017.1317735
- Buzney E, Sheu J, Buzney C, Reynolds RV. Polycystic ovary syndrome: A review for dermatologists. J Am Acad Dermatol. 2014;71(5):859.e1-859.e15. doi:10.1016/j.jaad.2014.05.009
- Amiri M, Ramezani Tehrani F, Nahidi F, Kabir A, Azizi F. Comparing the Effects of Combined Oral Contraceptives Containing Progestins With Low Androgenic and Antiandrogenic Activities on the Hypothalamic-Pituitary-Gonadal Axis in Patients With Polycystic Ovary Syndrome: Systematic Review and Meta-Analysis. JMIR Res Protoc. 2018;7(4):e113. doi:10.2196/resprot.9024
Anticonceptivos orales que trasforman la piel

En dermatología, los anticonceptivos orales tienen dos indicaciones principales. La primera es evitar el embarazo durante tratamientos como una opción anticonceptiva reversible y segura. 1,2
La segunda es el tratamiento de las manifestaciones cutáneas del hiperandrogenismo. Con evidencia en la mejoría del acné y el hirsutismo debido a que el componente progestágeno suprime la producción de andrógenos en el ovario y la parte estrogénica aumenta la producción de globulina fijadora de hormonas sexuales. En conjunto, estos dos mecanismos disminuyen los niveles de andrógenos circulantes, lo que, a su vez, produce una mejoría de los síntomas. 1,2
Aproximadamente, entre el 10% y el 20% de las mujeres presenta algún signo de androgenización y una parte de ellas tiene, además, alteraciones del ciclo menstrual obesidad, resistencia a la insulina, diabetes tipo 2 y aumento de lípidos séricos, de ahí la importancia de realizar una adecuada anamnesis y considerar los criterios médicos de elegibilidad para determinar el tipo de tratamiento indicado.
Los anticonceptivos orales con ciproterona son la elección en síndrome SAHA controlando acné severo, seborrea, alopecia y el hirsutismo, ya que actúan bloqueando los receptores de andrógenos y reduciendo la producción de estas hormonas.3
Beneficios en el tratamiento del acné
- Eficacia comprobada: Estudios han demostrado que la ciproterona, especialmente cuando se combina con etinilestradiol, es efectiva para reducir la severidad y el número de lesiones de acné4.
- Reducción del vello no deseado: Además de tratar el acné, la ciproterona también puede disminuir el crecimiento de vello no deseado en áreas como la cara, el pecho, piernas y el abdomen4.
Es importante que cualquier tratamiento con ciproterona sea supervisado por un médico para asegurar su seguridad y eficacia.
Referencias
- Sancho B. El uso de anticonceptivos en dermatología. Más Dermatol.2010;11:14-18.
- Requena C, Llombart B. Anticonceptivos orales en dermatología. Actas Dermosifiliogr. 2020;111(5):351-356.
- Ciproterona: Indicaciones, posología y efectos secundarios – CCM Salud
- https://cemes.es/guia-completa-sobre-la-ciproterona-y-el-etinilestradiol-usos-funciones-y-efectos/
Bienestar integral en el climaterio.

Para el año 2050, más de 1600 millones de mujeres en todo el mundo estarán en la etapa de menopausia o posmenopausia.1,2
Descubra cómo el climaterio afecta el bienestar emocional y la importancia de desarrollar un plan de atención personalizado para implementar estrategias de prevención efectivas.
Referencias
- British Menopause Society. Emotional wellness in menopause [Internet]. Women’s Health Concern Fact Sheet; 2023. Disponible en: https://n9.cl/x5ds8
- Roya College of Nursing. Menopause and Mental Health. RCN. 2022:1-30.
Eficacia y tolerancia en anticonceptivos orales

A lo largo de los años, la evolución de los anticonceptivos orales combinados (AOC) ha permitido la identificación de las formulaciones más eficientes. Entre ellas, la combinación de etinilestradiol y levonorgestrel ha demostrado ser una de las más destacadas desde su creación. A continuación, revisaremos cómo esta formulación se ha consolidado como una de las mejores opciones. 3,4,5

Los AOC actuales contienen dos componentes principales: un estrógeno y una progestina. Respecto al estrógeno, el estradiol (E2) es el más potente de forma natural y es producido principalmente por los ovarios. Sin embargo, su eficacia disminuye considerablemente cuando se administra por vía oral. Para resolver este problema, se añadió un grupo etinilo en la posición 17 del estradiol, creando el etinilestradiol (EE). Esta modificación no solo incrementa su potencia oral, sino que también mejora su estabilidad, ya que el EE no se une a la globulina fijadora de hormonas sexuales (SHBG), lo que le otorga mayor afinidad por los receptores de estrógeno y resistencia a la degradación enzimática. 3,4
En los primeros años del uso de las píldoras anticonceptivas, se identificaron problemas de salud, como el tromboembolismo venoso (TEV), especialmente vinculado a la dosis alta de estrógeno utilizada en ese entonces (150 mcg). Con el tiempo, la reducción progresiva de esta dosis resultó en las píldoras modernas que contienen entre 15 y 30 mcg de EE, manteniendo su eficacia con menos efectos secundarios adversos. 3,4

La dosificación de 30 mcg de EE, permanece como el “estándar de oro” en las formulaciones de los AOC. Por un lado permite una seguridad respecto de los posibles efectos adversos del componente estrógeno, y por otro lado, ofrece una garantía en el justo necesario para el adecuado control del ciclo de sangrado.
Aunque se han hecho esfuerzos por desarrollar AOC con estradiol en lugar de EE, el principal obstáculo ha sido el control deficiente del sangrado, lo que ha limitado su uso generalizado. 3
Respecto al componente progestina, la progesterona tiene una baja potencia cuando se administra por vía oral. En 1951, Carl Djerassi y su equipo descubrieron que al eliminar el carbono 19 de la etisterona, se transformaba el efecto hormonal de androgénico a progestacional. El levonorgestrel, derivado de la 19-nor-testosterona, pertenece a este grupo de progestinas, siendo una de las más utilizadas en los AOC actuales. 3
Tradicionalmente, los AOC contienen 21 pastillas activas de dosis fija de estrógeno y progestina, seguidas de un descanso de 7 días (esquema 21/7). Aunque se introdujeron píldoras trifásicas para imitar los ciclos naturales y minimizar los efectos androgénicos, no se ha demostrado que tengan ventajas significativas sobre las píldoras monofásicas. Además, las formulaciones trifásicas pueden generar confusión en las usuarias, especialmente cuando se olvida tomar una pastilla o cuando se busca el uso continuo para evitar la menstruación en períodos específicos, como vacaciones o eventos importantes. 3

Por último, algunas formulaciones más recientes que incluyen estradiol en combinación con nuevas progestinas requieren esquemas cuadrifásicos, lo que complica su administración y aumenta el riesgo de problemas en caso de omisión de dosis, comparado con las simples y eficientes píldoras monofásicas.3
Referencias
- Stewart M, Black K. Choosing a combined oral contraceptive pill. Aust Prescr. 2015 Feb;38(1):6-11. Review.
- Sonalkar S, Schreiber CA, et al. Contraception. 2014 Nov 11. In: Editors. Endotext.
- Brynhildsen Combined hormonal contraceptives: prescribing patterns, compliance, and benefits versus risks. Ther Adv Drug Saf. 2014 Oct;5(5):201-13. Review.
- Sitruk-Ware R, Nath A. Characteristics and metabolic effects of estrogen and progestins contained in oral contraceptive pills. Best Pract Res Clin Endocrinol Metab. 2013 Feb;27(1):13-24.
- Trussell J, Portman D. The creeping Pearl: Why has the rate of contraceptive failure increased in clinical trials of combined hormonal contraceptive pills? Contraception. 2013 Nov;88(5):604-10.
- Zimmerman Y, Eijkemans MJ, et al. The effect of combined oral contraception on testosterone levels in healthy women: a systematic review and meta-analysis. Hum Reprod Update. 2014 Jan-Feb;20(1):76-105.
- Kiley J, Hammond C. Combined oral contraceptives: a comprehensive review. Clin Obstet Gynecol. 2007 Dec;50(4):868-77.
- Vessey MP, Painter R. Endometrial and ovarian cancer and oral contraceptives—findings in a large cohort study. Br J Cancer. 1995;71: 1340–1342.
- Walker GR, Schlesselman JJ, et al. Family history of cancer, oral contraceptive use, and ovarian cancer risk. Am J Obstet Gynecol. 2002;186:8–14.
- Fraser I, McCarron G. Randomized trial of 2 hormonal and 2 prostaglandin-inhibition agents in women with a complaint of menorrhagia. Aust NZ J Obstet Gynecol. 1991;31:66–70.
Tecnología a favor de la vida
El impacto de la vitamina D en la piel
Historias de mujeres reales sobre menopausia

Ser atractiva era fundamental para ser mujer
ANA, 42 Oaxaca, México
Mi madre nunca habló conmigo sobre la relación que las mujeres deberían tener con su cuerpo. Lo que sí me enseñó es que ser atractiva era fundamental para ser mujer. Para mí, ser una mujer siempre ha involucrado dolor: menstruación; mi primera relación sexual; dar a luz; un par de cirugías ginecológicas y, recientemente, la menopausia.
Hace tres años, cuando tenía 39, un año después de divorciarme, mi doctor descubrió fibromas y me quitó la matriz y un ovario. Hace cinco meses, comencé a sentirme deprimida, cansada, a ganar peso y a dejar de dormir. No me sentía nada bien. Me diagnosticaron con perimenopausia hace unas semanas, y por increíble que parezca, la noticia me dio paz. Me sentí aliviada de saber que no estaba loca.
En mi juventud fui muy activa sexualmente, he tenido múltiples parejas. Ahora ya no recurro al sexo para encontrar intimidad. Quiero que mi menopausia dignifique quién soy. Recuerdo las enseñanzas de mi maestro tolteca* de Kabbalah:** “La menopausia es acoger a la sabia mujer que emerge de ti”. Me he apoyado en la Kabbalah en este proceso, y por eso ahora entiendo que existo para mí misma y para nadie más.
conozca más aquíReferencias
Violette R, Epstein I, Gibbons B. El siguiente capítulo. Historias de mujeres sobre menopausia. Abbott Laboratories; 2022
Transición cardiometabólica en la menopausia

Cambios que aumentan el riesgo cardiovascular
Durante la transición a la menopausia, el aumento de la adiposidad visceral da como resultado perfiles desfavorables de adipocinas que, a su vez, pueden conducir a la resistencia a la insulina y a dislipidemia. Así mismo, los cambios hormonales contribuyen a la activación del sistema renina-angiotensina y a factores endoteliales anormales, lo que puede provocar una reactividad vascular alterada y disfunción endotelial.1,2
Por otra parte, los síntomas vasomotores, las alteraciones del sueño y la depresión también se asocian con un aumento del riesgo de enfermedad cardiovascular (ECV) y de aterosclerosis subclínica.
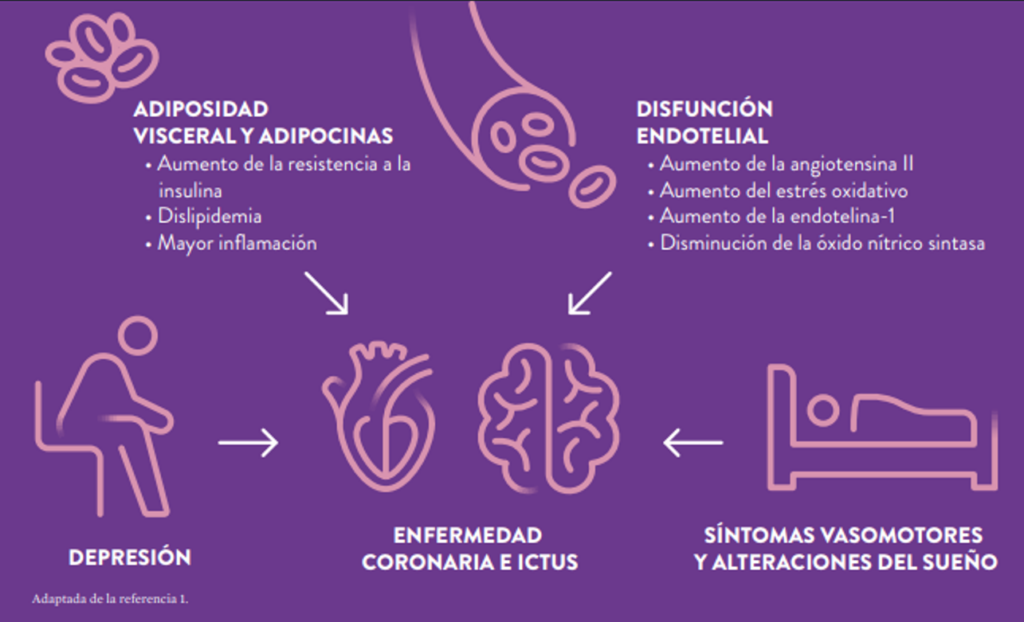
Otros factores que se relacionan con un mayor riesgo de ECV son:2,3
- Edad temprana en la menopausia natural (<45 años), especialmente en mujeres de raza negra o hispana.
- Menopausia inducida de forma iatrogénica (ooforectomía bilateral).
- Duración corta del ciclo menstrual.
- Baja paridad.
- Ser fumadora.
- Antecedentes cardiovasculares en la edad reproductiva.
Referencias
- Kim C. Management of Cardiovascular Risk in Perimenopausal Women with Diabetes. Diabetes Metab J. 2021;45(4):492-501.
- Lambrinoudaki I, Armeni E. Understanding of and clinical approach to cardiometabolic transition at the menopause. Climacteric. 2024;27(1):68-74.
- El Khoudary SR, Aggarwal B, Beckie TM, et al. Menopause Transition and Cardiovascular Disease Risk: Implications for Timing of Early Prevention: A Scientific Statement From the American Heart Association. Circulation. 2020;142(25):e506-e532.
- Liu Q, Si F, Liu Z, et al. Association between triglyceride-glucose index and risk of cardiovascular disease among postmenopausal women. Cardiovasc Diabetol. 2023;22(1):21.