Cistitis bacteriana: Una aproximación al diagnóstico y tratamiento

La Cistitis bacteriana se refiere a una infección aguda de la vejiga.1
| SÍNTOMAS | SÍGNOS CLÍNICOS |
| • Disuria • Frecuencia • Urgencia • Polaquiuria • Tenesmo Vesical • Dolor suprapúbico • Hematuria macroscópica (menos común) | • Dolor suprapúbico • Fiebre (muy frecuente – sospecha pielonefritis) |
La presencia de disuria y polaquiuria puede predecir el diagnóstico de cistitis en más del 90%.2
Referencias
1. Brown PD. Ciprofloxacin for the management of urinary tract infection. Women´s Health (Lond). 2006 Jul;2(4):509-16. doi:10.2217/17455057.2.4.509. PMID: 19803958. 2: 2012 Mar 15;366(11):1028-37, JAMA. 2002;287(20):2
2. N Engl J Med. 2012 Mar 15;366(11):1028-37, JAMA. 2002;287(20):2701–2710. doi:10.1001/jama.287.20.270
EFICACIA CLÍNICA Y SEGURIDAD A LARGO PLAZO EN EL TRATAMIENTO DE LA ENDOMETRIOSIS

El dienogest es una progestina de cuarta generación aprobada para el tratamiento de la endometriosis. 1-4
El objetivo principal del tratamiento de la endometriosis es el manejo de los síntomas, dado que estos afectan la calidad de vida de las mujeres (Figura 1).3, 4
Las progestinas se encuentran en la primera línea para el tratamiento del dolor asociado a la endometriosis.4, 6-8
Figura 1. Síntomas de la endometriosis 3
- Dolor Pélvico crónico
- Dismenorrea
- Dispareunia
- Disquecia
- Disuria
- Fatiga
- Infertilidad
Lo síntomas asociados a la endometriosis afectan de forma negativa la calidad de vida de las mujeres.3, 5
El tratamiento a largo plazo de la endometriosis debe equilibrar la eficacia clínica con la seguridad.4
Desde el año 2009 el dienogest de 2 mg fue aprobado por la Unión Europea para el tratamiento de la endometriosis.4
La eficacia y seguridad de dienogest 2 mg ha sido evaluada en 13 estudios clínicos a largo plazo con la inclusión de 2.031 mujeres tratadas (Figura 2). 4

13 estudios clínicos a largo plazo

Duración entre 1 y 5 años
2.031 mujeres tratadas
Figura 2. Estudios clínicos de dienogest hasta el año 2018 para el tratamiento a largo plazo de la endometriosis 4
Hasta el año 2018, se contabilizaban 13 estudios clínicos de dienogest para el tratamiento a largo plazo de la endometriosis.4
El promedio de duración del seguimiento en estos estudios era de 21 meses, con un rango desde 12 a 60 meses (5 años).4
Los estudios han demostrado que dienogest 2 mg es altamente eficaz para reducir: 4, 9-12
• El dolor crónico
• La dismenorrea
• La dispareunia asociada a la endometriosis
De igual forma, la administración a largo plazo de dienogest 2 mg mejora la calidad de vida de las pacientes.13
El tratamiento durante dos años con dienogest 2 mg demostró disminuir de forma progresiva el dolor crónico asociado a la endometriosis (Figura 3). 11
Figura 3. Cambios en los puntajes de dolor medidos con la EVA (escala visual análoga) en pacientes con endometriosis y dolor crónico11
Escala visual análoga
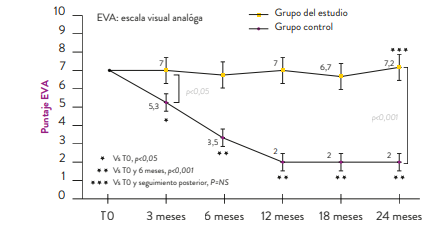
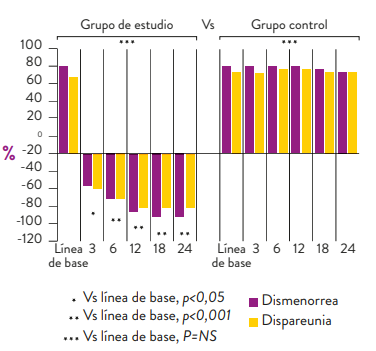
De igual forma, dienogest 2 mg (#7030A0), disminuye la dismenorrea logrando una reducción progresiva de la misma en 50,3%, 74,5%, 87,2%, 94,6% y 95,5% a los 3, 6, 12, 18 y 24 meses de tratamiento, respectivamente. (Figura 4)
Un control similar se logra para la dispareunia, llegando a una reducción de 74,4% a los 2 años (Figura 4). 11
Figura 4. Reducción de dismenorrea y dispareunia con dienogest 2 mg entre el 3er mes y el mes 24 de tratamiento 11
DIENOMET CONTROL EN MENOR TIEMPO DE LOS SÍNTOMAS2,4
Dienomet. Dienogest tabletas por 2 mg – 28 tabletas. Indicaciones: Tratamiento de la endometriosis Contenido: cada tableta contiene dienogest 2 mg. Excipientes c.s. Contraindicaciones y advertencias: antecedentes de tromboflebitis de las venas profundas y trastornos trombo-embólicos, arteriopatía de las coronarias o enfermedad cerebrovascular, carcinoma mamario conocido o sospechado, neoplasia estrógeno-dependiente conocida o sospechada, hemorragia vaginal anormal sin diagnosticar. Embarazo conocido o sospechado, perturbación de la función hepática, antecedentes de ictericia idiopática del embarazo, síndrome de dubin-jhonson, trastorno del metabolismo de la grasa, antecedentes de herpes del embarazo, diabetes y otoesclerosis con empeoramiento durante el embarazo. Dosis: según prescripción médica. Vía de administración: oral. Venta bajo fórmula médica. Manténgase fuera del alcance de los niños. Almacénese a no más de 30°C. Registro sanitario INVIMA 2022M-0012966-R2. Elaborado por Lafrancol S.A.S Cali – Colombia.
Referencias
Referencias: 1. Instituto Nacional de Vigilancia de Medicamentos y Alimentos. Dienomet. Resumen de características de producto (RCP) en medicamentos. [en línea]. Disponible en: www.invima.gov.co Consultado: 17 02 2021. 2. Foster RH. Dienogest. Drugs 1998: 56: 825-33. 3. Zondervan KT, Becker CH, Missmer SA. Endometriosis. N Engl J Med 2020; 382: 1244-56. 4. Murjy A, Biberoğlu K, Leng J, et al. Use of dienogest in endometriosis: a narrative literature review and expert commentary. Curr Med Res Opin 2020; 36: 895-907. 5. Della Corte L, Di Filippo C, Gabrielli O, et al. The Burden of Endometriosis on Women’s Lifespan: A Narrative Overview on Quality of Life and Psychosocial Wellbeing. Int J Environ Res Public Health 2020; 17(13):4683. 6. National Institute for Health and Care Excellence. Endometriosis: diagnosis and management. [en línea]. Disponible en: https://www.nice.org.uk/guidance/ng73/resources/endometriosis-diagnosis-and-management-pdf-1837632548293 Consultado: 17 02 2021. 7. Amstrong C. ACOG Updates Guideline on Diagnosis and Treatment of Endometriosis. Am Fam Phys J 2011: 83; 84-5. 8. Dunselman GA, Vermeulen N, Becker C, et al. ESHRE guideline: management of women with endometriosis. Hum Reprod 2014; 29: 400-12. 9. Andres MP, Alves L, Chada E, Podgaec S. Dienogest in the treatment of endometriosis: systematic review. Arch Gynecol Obstet 2015; 292: 523-29. 10. Heinemann K, Imthurn B, Marions L, et al. Safety of Dienogest and Other Hormonal Treatments for Endometriosis in Real-World Clinical Practice (VIPOS): A Large Noninterventional Study. Adv Ther 2020; 37: 2528-37. 11. Römer T. Long-term treatment of endometriosis with dienogest: retrospective analysis of ecacy and safety in clinical practice. Arch Gynecol Obstet 2018; 298: 747-53. 12. Techatraisak K, Hestiantoro A, Ruey S, et al. Eectiveness of dienogest in improving quality of life in Asian women with endometriosis (ENVISIOeN): interim results from a prospective cohort study under real-life clinical practice. BMC Womens Healt 2019; 19(1):68. 13. Caruso S, Iraci M, Cianci S, et al. Eects of long-term treatment with Dienogest on the quality of life and sexual function of women aected by endometriosis-associated pelvic pain. J Pain Res 2019; 12: 2371-78.
Líneas de Expresión
Son aquellas arrugas que se producen por contracción repetida de los músculos de la cara.
¿Por qué aparecen las líneas de expresión?
La formación de estas se debe a una falta de colágeno y elastina en la piel.
El colágeno y la elastina crean la estructura de soporte de la piel otorgándole firmeza y elasticidad. Cuando estas fibras se desintegran, la piel comienza a perder tonicidad y elasticidad. Cuando esto sucede, aparecen las arrugas y lineas de expresión. En la mayoría de los casos las exposición a los rayon nocivos UV es la principal causa de envejecimiento prematuro responsable de la aparición de las líneas de expresión, las arrugas y textura aspera en la piel.
Identificando las líneas de expresión
Arrugas en la frente:
Aparecen entre las cejas y la base del cabello horizontalmente. Debido al paso de los años, la piel pierde elasticidad y los músculos elevadores se acortan haciendo que los pliegues de la frente se vuelvan permanentes.
Arrugas del Entrecejo:
Es la arruga vertical que aparece entre las cejas al fruncir el ceño, la mayoría de las veces de manera inconsciente. Al igual que todas las arrugas de expresión surge de la combinación de dos factores, la contracción del músculo y la pérdida de elasticidad de la piel.
Arrugas en el contorno de ojos:
La zona del contorno de los ojos es extremadamente frágil y sensible, la más delicada del rostro ya que se trata del área con menor cantidad de glándulas sebáceas, colágeno y elastina. Las llamadas “patas de gallo” son unas arrugas muy finas y horizontales que que aparecen a ambos lados de los ojos y se producen por diversos factores como el paso de los años, la exposición solar prolongada, la contaminación, el tabaco o el consumo de alcohol.
Recomendaciones
Lamentablemente, el colágeno y la elastina van desapareciendo a medida que envejecemos. sin esta fuerte estructura de soporte, la piel se vuelve menos firme y pierde su elasticidad, lo que puede provocar la aparición de las líneas de expresión y las arrugas. No existe una forma de evitar que la piel envejezca, pero si te daremos recomendaciones para lograr que este efecto se retrace.
Protegerse del sol:
Diariamente aplica protector solar recomendado por tu dermatólogo para que tu piel esté protegida de los rayos del sol.
Hidrata y protege siempre la piel de tu rostro:
Utiliza una crema hidratante con un alto factor de protección solar. Además de hidratar, preservará tu piel de los rayos nocivos del sol.
Aplica productos específicos:
Usa a diario un contorno de ojos antiarrugas. Especialmente recomendables son aquellos que contienen ácido hialurónico en su formulación ya que estimula la producción de colágeno. Elige una crema adecuada para tu tipo de piel.
Come alimentos saludables:
Introduce en tu dieta alimentos antioxidantes que evitan la formación de los radicales libres.
Referencias
1. https://www.mejorconsalud.com/5-remedios-para-atenuar-las-lineas-de-expresion/
Todo lo que debe saber sobre la isotretinoina y el acné
Se cree que la isotretinoína mejora el acné al reducir el tamaño y la producción de sebo de las glándulas sebáceas, normalizar la queratinización folicular, inhibir el crecimiento de Cutibacterium acnés (anteriormente llamado Propionibacterium acnes) a través de un cambio en el medio folicular y al reducir la inflamación.
El principal metabolito de la isotretinoína es el ácido 13-cis-4-oxo-retinoico; sin embargo, existen varios otros metabolitos. Isotretinoína y 4-oxoisotretinoína alcanzan concentraciones de estado estacionario dentro de los 10 días posteriores a una dosis de 40 mg dos veces al día. Después de suspender el tratamiento, los niveles de isotretinoína y ácido 13- cis-4-oxo-retinoico disminuyen, con semividas de eliminación terminal promedio de aproximadamente 19 y 29 horas, respectivamente. En pacientes tratados con isotretinoína en dosis de 0,5 a 1 mg/kg/día, la isotretinoína y sus metabolitos vuelven a las concentraciones endógenas dentro de las 2 semanas posteriores a la suspensión de la isotretinoína.
La isotretinoína oral actúa como un potente inhibidor de la actividad de las glándulas sebáceas a través de muchas vías y también tiene propiedades antiinflamatorias e inmunorreguladoras, mediante la regulación a la baja de las células TLR 2: receptor tipo Toll y 4 y Th: linfocitos T helper
Los medicamentos contra el acné, incluida la isotretinoína, estimulan la expresión del gen p53. Se considera el conductor clave entre las vías de señalización activadas y reducidas, como la apoptosis y la lipogénesis.
Se reconoce que la isotretinoína oral promueve la apoptosis de las células de las glándulas sebáceas reduciendo la producción de sebo, ya que regula al alza la expresión de las proteínas nucleares FoxO1 y FoxO3.
El acné es una enfermedad crónica, inflamatoria e inmunomediada de la unidad pilosebácea, altamente prevalente. El tratamiento temprano, efectivo y seguro es la clave para la resolución de la enfermedad.
La isotretinoína oral es el único tratamiento para la curación o remisión prolongada del acné moderado y severo, previniendo el impacto psicosocial y las cicatrices. Inhibe la actividad de las glándulas sebáceas y tiene propiedades antiinflamatorias e inmunorreguladoras.
Referencias
1. Fallah H, Rademaker M. Isotretinoin in the management of acne vulgaris: practical prescribing. Int J Dermatol. 2021 Apr;60(4):451-460. doi: 10.1111/ijd.15089. Epub 2020 Aug 29. PMID: 32860434.
2. Bagatin E, Costa CS. The use of isotretinoin for acne – an update on optimal dosing, surveillance, and adverse effects. Expert Rev Clin Pharmacol. 2020 Aug;13(8):885-897. doi: 10.1080/17512433.2020.1796637.2. Teng Y, Fan Y, Ma J, Lu W, Liu N, Chen Y, Pan W, Tao X. The PI3K/Akt Pathway: Emerging Roles in Skin Homeostasis and a Group of Non-Malignant Skin Disorders. Cells. 2021 May 17;10(5):1219. doi:10.3390/cells10051219.
Tratamiento seguro y efectivo del acné severo con la dapsona
En diferentes estudios como los llevados a cabo por Wakabayashi et al.,1 y el de Pickert A y Raimer S2 se encontró que la dapsona en gel al 5% es un tratamiento eficaz y seguro para el manejo del acné severo. Pickert A y Raimer S desarrollaron un estudio doble ciego, aleatorizado, en grupos paralelos, que evaluó la eficacia de la dapsona en gel al 5%. El estudio contó con 111 personas de ambos sexos entre los 12 y 81 años, y tuvo una duración de 12 meses. El medicamento se aplicó dos veces al día en la zona afectada en una dosis de 1,35 g.
Tratamiento en adolescentes:
En el subgrupo de población adolescente (12 a 15 años de edad) se demostró una reducción en todas las lesiones de acné durante el cuarto y sexto mes de terapia. Los factores de seguridad y tolerabilidad fueron similares a los del grupo de adultos.
Los resultados fueron positivos, pues a los 12 meses de completar el tratamiento se evidenció una reducción del 49% en las lesiones de acné inflamatorias y no inflamatorias. A la vez, la investigación demostró que desde el primer mes se registraron avances notables en el mejoramiento de las lesiones inflamatorias, que continuaron durante los siguientes tres a seis meses.
Se concluyó que la aplicación de la dapsona al 5% en gel dos veces al día es efectiva para el tratamiento del acné severo, obteniendo resultados desde el primer mes de aplicación y mejoras notables entre los dos o tres meses de tratamiento.
La investigación demostró que los pacientes a quienes se administró la dapsona en gel al 5% presentaron menos efectos adversos que quienes recibieron el medicamento por vía oral. Tan solo el 13% de los pacientes reportó efectos adversos no graves, como resequedad (2,9%) y sarpullido (2,5%) moderados. Los pacientes no registraron eventos adversos graves. Los resultados de seguridad fueron similares tanto en la población adulta como en la adolescente.
Mecanismo de acción de la dapsona en gel al 5%:
Los estudios demuestran que la dapsona cuenta con una acción antimicrobiana similar a la de las sulfonamidas, que se da por medio de la inhibición de la síntesis bacteriana del ácido dihidrofólico, generando reacciones en contra de la bacteria asociada al acné P. acnes. Hasta el momento no existen estudios sobre el funcionamiento del componente antimicrobiano de la dapsona como agente antiacné.
A la vez, la dapsona también actúa como un agente antiinflamatorio. Aunque aún no se ha entendido el mecanismo de acción exacto de este fármaco como antiinflamatorio, algunos estudios han demostrado que la dapsona inhibe la actividad de neutrófilos y de eosinófilos, suprime la producción de ácido hipocloroso y la actividad de los neutrófilos e inhibe la transducción de señales inducidas por atracción química.
Aunque se cuenta con esta información sobre los mecanismos de acción de la dapsona, no se sabe con exactitud si este medicamento actúa como un antibiótico en contra de la bacteria P. acnés, como un antiinflamatorio ante las lesiones, o como una combinación de ambos mecanismos.’ Sin embargo, estudios como el de Jerry Tan afirman que la eficacia de la dapsona se debe a la combinación de los dos mecanismos de acción: antibiótico y antiinflamatorio.
Eficacia de la dapsona frente a otros antibióticos:
Según el estudio de Pickert y Raimer, la bacteria asociada al acné P.acnes ha presentado, en los últimos años, una resistencia a los antibióticos eritromicina y clinadamicina debido al extenso uso tópico de estos dos agentes. Lo anterior ha generado dificultades a la hora de tratar los problemas del acné. La dapsona tópica se presenta como una nueva alternativa a los tratamientos actuales para el acné.
Beneficios farmacocinéticos de la dapsona:
Tras una investigación que recopiló tres estudios sobre la famacocinética de la dapsona en gel al 5% se encontraron los siguientes beneficios:
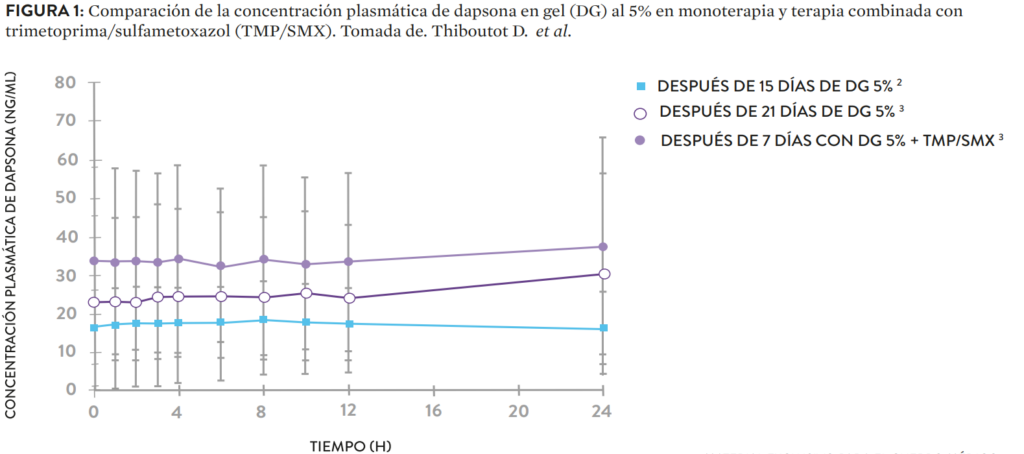
- Menor concentración plasmática en comparación con la dapsona por vía oral. El primer estudio de la investigación comparó la concentración plasmática de la dapsona tópica con la formulación por vía oral. Para el estudio se cotejó el área bajo la curva (ABC) de 24 horas del medicamento en gel al 5% con el ABC al infinito de este mismo via oral, durante 14 días. Los resultados encontraron que la dapsona tópica cuenta con una concentración plasmática 126 veces menor que la dapsona via oral. El ABC24 del medicamento tópico fue de 417,5 ng/h/ml, mientras que el ABC de la formulación para vía oral fue de 52,64 ng/h/ml. Lo anterior se registra como un buen dato si se tiene en cuenta los graves efectos adversos de la dapsona en altas concentraciones plasmáticas, tales como la metahemoglobinemia, la hemólisis y la agranulocitosis.
- Estabilidad de la dapsona en las terapias concomitantes. Otro de los estudios analizó el comportamiento farmacocinético de la dapsona cuando se utiliza junto con el trimetoprima/sulfametoxazol. Para esta prueba se analizó cada medicamento individualmente: la dapsona por tres semanas y el trimetoprima/sulfametoxazol por ocho días. Luego de esto, durante una semana se administró a los sujetos del estudio los dos medicamentos simultáneamente. El estudio encontró que la dapsona no ejerció ningún efecto sobre las concentraciones plasmáticas del trimetoprima/sulfametoxazol, mientras que este último medicamento sí ejerció un efecto sobre la dapsona al duplicar su ABC (figura 1). Sin embargo, el incremento del área bajo la curva no alcanzó a tener altas concentraciones, por tanto, su buen perfil de seguridad no se vio afectado.
Conclusiones
Según los estudios, la dapsona tópica es eficaz en el tratamiento de acné leve y severo con nódulo quístico en todo tipo de lesiones y se comprobó que su uso proporciona una mayor reducción en lesiones de tipo inflamatorio gracias a sus propiedades
Referencias
1. Data IQVIA antiacné topicos de marca maya 2024.
2. Wakabayashi M, Fujii N, Fujimoto N, Tanaka T. Utilidad de la dapsona para el tratamiento de casos severo s de acné en asiáticos. Jpn J Dermatol B. 2013; 502-503.
3. Zoe D. Draelos et.al. Two randomized studies demonstrate the efficacy and safety of dapsone gel, 5% for the treatment of acne vulgaris. J Am Acad Dermatol. 2007; 3 (56): 439.e1 – 439.e10.
Etoricoxib para el alivio de la inflamación
ETORICOXIB
Los procedimientos quirúrgicos causan inevitablemente heridas, dolor posoperatorio (POP) y sangrado perioperatorio. La Organización Mundial de la Salud (OMS) ha indicado el uso de fármacos como acetaminofén, antiinflamatorios no esteroideos (AINE) y opioides como medida terapéutica de estas afecciones, siendo los AINE ampliamente recomendados por su acción antiinflamatoria y analgésica. En el siguiente QR veremos los beneficios en cuanto a seguridad de los inhibidores de la COX-2 selectivos en los pacientes con dolor POP
La osteoartritis es una de las principales causas de morbilidad y discapacidad en todo el mundo, que por su naturaleza crónica como objetivos de tratamiento pretende modular el dolor, mejorar la funcionalidad y reducir la discapacidad del paciente; el analgésico oportuno para lograr esos objetivos terapéuticos en el paciente es el Etoricoxib. Lo invitamos a escanear el QR para ver el video en el que conversamos a la luz de la evidencia científica sobre el uso de Etoricoxib en dolor crónico
Manejar el dolor crónico en ocasiones es todo un desafío, por lo que se hacen necesarios analgésicos que tengan una eficacia sostenida en el tiempo, que en patologías como osteoartritis tengan un efecto tanto analgésico como antiinflamatorio y que, además, tengan un buen perfil de seguridad. lo invitamos a escanear el QR para descubrir en este video el analgésico que le confiere todos estos beneficios. Lograr la modulación del dolor agudo de su paciente lo más pronto posible y con el adecuado perfil de seguridad gastrointestinal, le brindará al paciente una recuperación en bienestar. Lo invitamos ver el siguiente video para profundizar en este tema.
Hidrocodona vs tramadol: mecanismos
Hidrocodona:

Hidrocona es un opioide relativamente potente para el control del dolor de intensidad moderada a severa en pacientes posoperatorios, pacientes con trauma y pacientes oncológicos.
Hidrocodona es un agonista completo de opioides que interactúa con el receptor mu y, en menor medida, con los receptores delta. Al activarse, los receptores mu-opioides llevan a la inhibición de los reflejos del dolor nociceptivo e inducen una analgesia profunda sin afectar otras modalidades sensoriales como el tacto; además, los receptores opioides activados inhiben la liberación de neurotransmisores, incluyendo la sustancia P.
Tramadol:

Tramadol, por su parte, posee una unión de baja afinidad al receptor mu-opioide, lo cual limita en parte su efectividad en el tratamiento del dolor agudo.2 Tramadol, además, no posee acción anti-prostaglandina.
Algunos estudios han mostrado que el tramadol proporciona un nivel de analgesia inferior y un perfil de tolerabilidad menos deseable comparado con otros antiinflamatorios no esteroideos en el manejo del dolor posoperatorio.
Seguridad: Efectos adversos (EA) reportados

En un estudio realizado por Rauck y cols., muchos de los pacientes incluidos encontraron un alivio efectivo del dolor a 200 mg/d de tramadol, pero otros requirieron dosis de hasta 400 mg/d. En ese estudio, el 19% de los pacientes que tomaban tramadol interrumpieron el tratamiento debido a eventos adversos, el 12% debido a síntomas gastrointestinales.
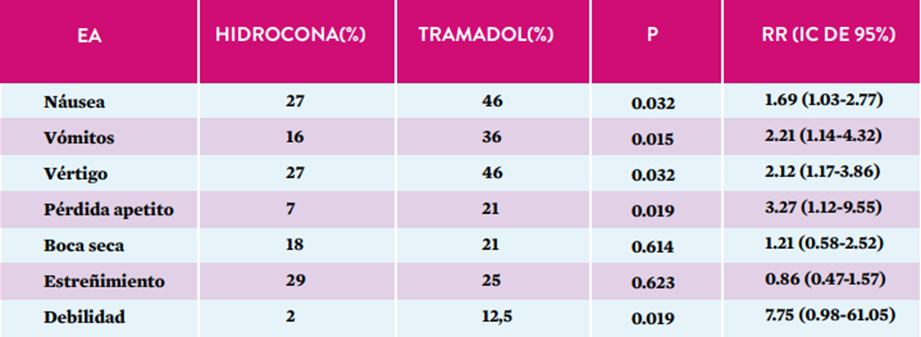
En un estudio realizado por Rodríguez y cols., se reportaron los EA, en ambos grupos (tramadol versus hidrocodona), que se muestran en la tabla
Principios de equivalencia analgésica
Hidrocona
La potencia relativa de HIDROCODONA en relación con otros opioides no se ha estudiado completamente; se basa más bien en la práctica clínica y el conocimiento empírico. La hidrocodona no está incluida en la tabla de dosis equianalgésica original. En aquellas tablas donde se incluye siempre se considera una relación 1:1 con morfina oral. En estas tablas, se pueden observar pares de dosis equianalgésicas tales como 20-30 mg de morfina oral equivalentes a 20-30 de hidrocodona oral, 30 mg de morfina oral equivalente a 30-45 mg de hidrocodona oral, o 30 mg de morfina oral equianalgésicos a 30 mg de hidrocodona oral. A pesar de las importantes limitaciones de la evidencia disponible, las recomendaciones son lo suficientemente consistentes para determinar una proporción 1:1 con respecto a la morfina oral.
Tramadol
Por su parte, de manera muy consistente se ha encontrado que la potencia relativa de la morfina parenteral con respecto al tramadol parenteral es 1:10 a 1:11, y la recomendación más repetida y utilizada es 1:10. Algunas tablas recomiendan esta misma proporción 1:10 al convertir las dosis entre morfina y tramadol orales. La biodisponibilidad del tramadol oral (80% a 100%), sin embargo, es mucho más alta que la de la morfina oral (30% a 50%), por lo que mantener la proporción 1:10 sería erróneo. En los estudios de rotación de opioides, las proporciones finales se encontraron entre 1: 3,8 y 1: 5,3. Existen muchas tablas que recomiendan una relación 1:5 entre la morfina y el tramadol orales, pero no provienen de estudios clínicos.
Hidrocodona muestra un mejor perfil de farmacodinamia, efectividad equianalgésica y un mejor perfil de seguridad que tramadol.
Referencias
1. Habibi M, Kim PY. Hydrocodone and Acetaminophen. In: StatPearls. StatPearls Publishing; 2021. Accessed April 23, 2021. http://www.ncbi.nlm.nih.gov/books/NBK538530/
2. Turturro MA, Paris PM, Larkin GL. Tramadol versus hydrocodone-acetaminophen in acute musculoskeletal pain: a randomized, double-blind clinical trial. Ann Emerg Med. 1998;32(2):139-143. doi:10.1016/s0196-0644(98)70127-1
3. Hernández-Ortiz A. Construction of a nomogram to facilitate the calculation of equianalgesic doses for opioid rotation. 2016;39(4):10.
4. Rauck RL, Ruo GE, McMillen JI. Comparison of tramadol and acetaminophen with codeine for long-term pain management in elderly patients. Curr Ther Res. 1994;55(12):1417-1431. doi:10.1016/S0011-393X(05)80748-9
5. Rodriguez RF, Castillo JM, Castillo MP, et al. Hydrocodone/Acetaminophen and Tramadol Chlorhydrate Combination Tablets for the Management of Chronic Cancer Pain: A Double-blind Comparative Trial. Clin J Pain. 2008;24(1):1-4. doi:10.1097/AJP.0b013e318156ca4d
Tecnología que salva vidas:
Sólo en el 2022, la neumonía cobro la vida de 7.314 colombianos.
La adición temprana de claritromicina a los pacientes diagnosticados con neumonía puede ayudar a salvarles la vida. El efecto inmunomodulador de la claritromicina ayuda a mejorar la respuesta clínica temprana y a retrasar la progresión del fallo de órganos, como lo demostró el estudio Access publicado en The Lancet en el año 2024.
Claritromicina 500 mg dos veces al día vo por 7 días en adición al tratamiento estándar de la nac*, mejora la respuesta clínica temprana y atenúa la carga inflamatoria.
El mecanismo de beneficio está asociado con cambios en la respuesta inmune.
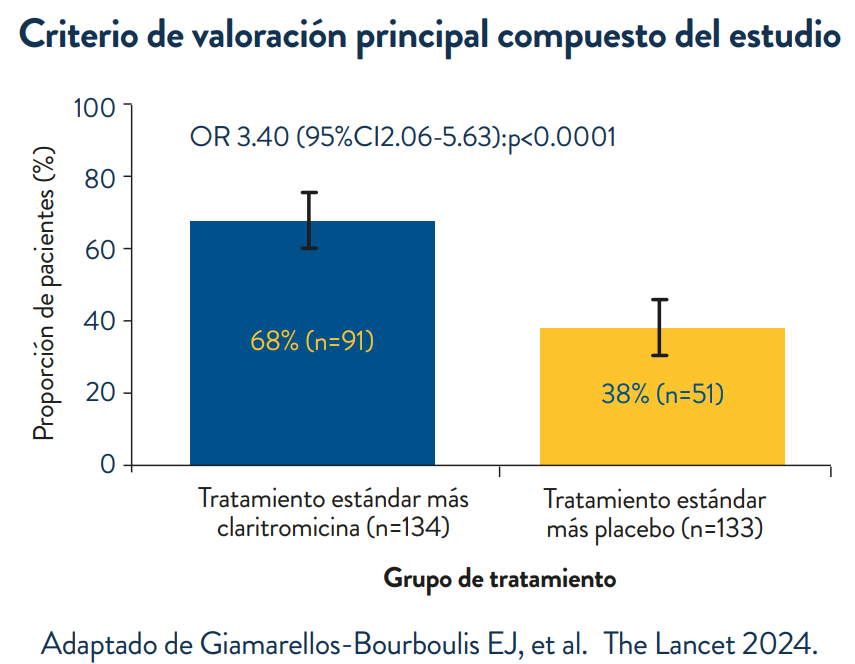
El criterio de valoración principal compuesto se evalúa el día 4 de tratamiento y requiere que se cumplan dos componentes: (1) respuesta clínica temprana según lo definido por la EMA y la FDA (cualquier disminución del 50% o más en la puntuación de gravedad de los síntomas respiratorios en comparación con la visita 1); y (2) cualquier disminución del 30 % o más en la puntuación de la Evaluación de insuficiencia orgánica secuencial o un cambio favorable en la cinética de la procalcitonina (definida como una disminución 80 % de la procalcitonina en comparación con la visita 1 o la procalcitonina en sangre.
Las proporciones de pacientes con progresión a disfunción orgánica y desarrollo de nuevos episodios de sepsis fueron significativamente menores en el grupo de claritromicina.
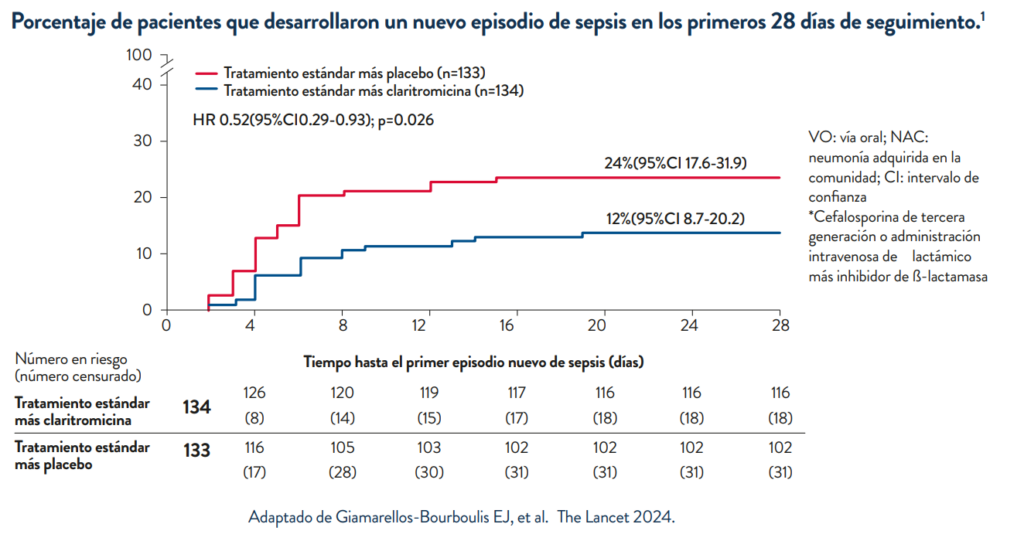
Estudio access: Claritromicina para respuestas antiinflamatorias tempranas en la neumonía adquirida en la comunidad en Grecia (ACCESS): un ensayo aleatorizado, doble ciego y controlado con placebo.
Métodos: Ensayo controlado aleatorio, prospectivo, doble ciego, de fase 3, en el que participaron adultos hospitalizados con neumonía adquirida en la comunidad que tenían síndrome de respuesta inflamatoria sistémica, puntuación de Evaluación de insuficiencia orgánica secuencial (SOFA) de 2 o más y procalcitonina 0 25 ng/ml o más en 18 departamentos de medicina interna de hospitales públicos griegos. Los pacientes fueron asignados aleatoriamente (1:1) mediante aleatorización en bloques generada por computadora a la medicación estándar (incluida la administración intravenosa de una cefalosporina de tercera generación o la administración intravenosa de una combinación de ß-lactámico más inhibidor de ß-lactamasa) más placebo oral o administración oral de claritromicina 500 mg dos veces al día durante 7 días. Los investigadores, el personal y los pacientes estaban cegados a la asignación de grupos. El criterio de valoración principal compuesto requirió que los pacientes cumplieran las siguientes condiciones después de 72 horas (es decir, el día 4 de tratamiento): (1) disminución en la puntuación de gravedad de los síntomas respiratorios del 50% o más como indicador de respuesta clínica temprana y (2) disminución en la puntuación SOFA de al menos el 30% o una cinética favorable de la procalcitonina (definida como una disminución 80 % desde el valor inicial o procalcitonina
Hallazgos: 278 pacientes fueron asignados al azar para recibir atención estándar en combinación con claritromicina (n=139) o placebo (n=139). En el análisis del criterio de valoración principal se incluyeron 134 pacientes del grupo de claritromicina (cinco retiraron su consentimiento) y 133 pacientes del grupo de placebo (seis retiraron su consentimiento). El criterio de valoración principal se cumplió en 91 (68%) pacientes del grupo de claritromicina y 51 (38%) pacientes del grupo de placebo (diferencia 29 6% [IC 95% 17 7 – 40 3]; odds ratio [OR] ] 3 40 [IC 95% 2 06–5 63]; p.
Interpretación: La adición de claritromicina al tratamiento estándar mejora la respuesta clínica temprana y atenúa la carga inflamatoria de la neumonía adquirida en la comunidad. El mecanismo del beneficio está asociado con cambios en la respuesta inmune. Estos hallazgos sugieren la importancia de agregar claritromicina a los -lactámicos para el tratamiento de pacientes hospitalizados con neumonía adquirida en la comunidad para lograr una respuesta clínica temprana y una disminución temprana de la carga inflamatoria.
Referencias
1. Sas, C. (2023, 26 enero). ¿Cuáles fueron las principales causas de muerte Colombia 2022? CONSULTORSALUD. https://consultorsalud.com/principales-causas-muerte-colombia-2022/ 2. Giamarellos-Bourboulis EJ, et al. Clarithromycin for early anti-inflammatory responses
in community-acquired pneumonia in Greece (ACCESS): a randomised, double-blind, placebo-controlled trial. www.thelancet.com/respiratory Published online January 3, 2024 https://doi.org/10.1016/S2213-2600(23)00412-5
Diagnóstico del vértigo periférico un movimiento cuidadoso
En realidad, el vértigo no es en sí mismo un diagnóstico, sino un síntoma de un diagnóstico, cuya definición depende de la combinación de la historia clínica, con preguntas clave, la exploración física y los exámenes.1 El curso temporal de los síntomas, cualquier síntoma acompañante y los factores precipitantes o moduladores son las pistas más importantes para establecer el diagnóstico y, de esta manera, ayudar al paciente a restablecer el equilibrio. Por ende, escuchar y examinar cuidadosamente facilita el diagnóstico correcto de los síndromes de vértigo más comunes.
Diagnóstico del vértigo periférico
ANAMNESIS Como siempre, para establecer un diagnóstico adecuado, es necesario hacer una historia clínica completa que incluya: • Fecha de iniciación • Número de episodios • Duración • Características de cada episodio • Síntomas y signos asociados • Tratamientos recibidos • Exámenes paraclínicos ya realizados. Se debe hacer un examen físico completo en ORL otoscopia y otoscopia neumática, haciendo test de fístula para descartar fístula perilaberíntica. Así mismo, se debe realizar un examen neurológico básico que incluya el examen de todos los pares craneales. El Cover Test es de mucha utilidad como ayuda en el diagnóstico diferencial con vértigo de origen central. Se deben efectuar pruebas cerebelosas (prueba de Romberg, Unterberger, test para detectar disdiadococinesia) y pruebas posicionales. En algunos casos seleccionados, se requiere solicitar exámenes electrofisiológicos.
Exámenes de laboratorio
Se deben solicitar siempre exámenes de laboratorio, química sanguínea completa para descartar problemas metabólicos asociados a la aparición de vértigo.
1. Glicemia pre y posprandial sin carga
2. Perfil lipídico completo
3. Ácido úrico
4. BUN
5. Creatinina
6. T3, T4 y TSH
7. FTA-Abs
También, en algunas ocasiones, es necesario pedir imágenes diagnósticas, básicamente resonancia magnética de oídos con gadolinio, con la cual se descartan patologías de ángulo pontocerebeloso, fosa posterior, ensanchamientos anormales de saco endolinfático en la enfermedad de Ménière, entre otros.
Igualmente, siempre se deben pedir exámenes de audición, audiometría, logo audiometría e impedanciometría.
Referencias
1. Strupp M, Dlugaiczyk J, Ertl-Wagner BB, Rujescu D, Westhofen M, Dieterich M. Vestibular Disorders. Dtsch Arztebl Int. 2020;117(17):300-310.
2. American Speech-Language-Hearing Association. Diagnosis and Management. ASHA; 2016. Disponible en: https://bit.ly/3hT7eHZ
3. Cummings C, Fredrickson J.M., Harker L.A. et al. OTOLARYNGOLOGY HEAD & NECK SURGERY Third ed. Mosby on line. Cap. 132-140, 159, 161-171 1999-2003.
4. Blevins N. et al.Temporal Bone Dissector 1999.
5. Furman J.M., Cass S.P. , Benign Paroxysmal Positional Vertigo, The New England Journal of Medicine, Volume 341 Number 21, Pag. 1593 November 18,1999.
6. Lee K.J. Essential Otolaryngology Caps 1, 4, 8, 16, 32, 33, 43. Seventh Edition 1999.
7. Does betahistine treatment have additional benefits to vestibular rehabilitation?
Hale Karapolat · Nese Celebisoy · Yesim Kirazli, Eur Arch Otorhinolaryngol (2010) 267:1207–1212
8. Botta L, Mira E, Valli S, Zucca G, Perin P, Benvenuti C, Fossati A, Valli P (June 2001). “Effects of betahistine and of its metabolites on vestibular sensory organs.”. Acta Otorhinolaryngol Ital. 21 (3 Suppl 66): 24– 30. PMID 11677836.
9. National Institute on Deafness and Other Communication Disorders (NIDCD). Strategic plan (FY 2006-2008). June 12, 2009.
10. ¿Does betahistine treatment have additional benefits to vestibular rehabilitation?
Hale Karapolat · Nese Celebisoy · Yesim Kirazli, Eur Arch Otorhinolaryngol (2010)
267:1207–1212
11. Devaraja K, Vertigo in Children; a narrative review of the various causes and their management . International Journal of Pediatric Otorhinolaryngology 111 (2018) 32-38
12. Botta L, Mira E, Valli S, Zucca G, Perin P, Benvenuti C, Fossati A, Valli P (June 2001). “Effects of betahistine and of its metabolites on vestibular sensory organs.”.
Acta Otorhinolaryngol Ital. 21 (3 Suppl 66): 24–30. PMID 11677836.
13. Diagnosis and Treatment of Vertigo and Dizziness. Michael Strupp, Thomas Brandt.
Deutsches Ärzteblatt International. 2008 March; 105(10): 173-180. Munich Center of
NeuroSciences
14. Long-term prophylactic treatment of attacks of vertigo in Ménière’s diseasecomparison of a high with a low dosage of beta heisting in an open trial. Strupp M., Hupert D., Frenzel C., Wagner J., Hahn A., Jahn K., Zinglerr VC?, Mansmann U.,
Brandt T. Acta Otolaryngolgy 2008,May; 128(5): 520-4
15. Lacour, M., van de Heyning, P. H., Novotny, M., & Tighilet, B. (2007).Betahistine
in the treatment of Ménière’s disease. Neuropsychiatric Disease and Treatment,
3(4), 429–440.
16. Lacour M. 1* and Laurence BernardDemanze1,2. Interaction between vestibular compensation mechanisms and vestibular rehabilitation therapy: 10 recommendations for optimal functional recovery. 1 Laboratoire de Neurobiologie Intégrative et Adaptative,UMR7260CNRS/UniversitéAix-Marseille,FédérationdeRe cherche3C, CentredeSt Charles, France.2 Serviced’otorhinolaryngologieetd’otoneurologie, CHUNord, ssistance Publique Hôpitauxde Marseille, Marseille. Frontiers in Neurology | Neuro-otology.
January 2015 | Volume 5 | Article 285 | 1
17. Ihler F, Bertlich M, Sharaf K, Strieth S, Strupp M and Canis M. (2012) Betahistine
exerts a dose-dependent effect on cochlear stria vascularis blood flow in Guinea pigs in
vivo. PLoS One 7(6):e39086
18. Kerber KA. Vertigo and dizziness in the emergency department. Emerg Med Clin
North Am. 2009;27:39-50.
19. Tusa RJ. Dizziness. Med Clin North Am. 2009; 93:263-271.
20. Swartz R. Treatment of vertigo. Am Fam Physician. 2005; 71(6): 1115-1122.
21. Crane BT, Schessel DA, Nedzelski J, Minor LB. Peripheral vestibular disorders. In:
Cummings CW, Flint PW, Haughey BH, et al, eds. Otolaryngology: Head & Neck Surgery. 5th ed. Philadelphia, Pa: Mosby Elsevier; 2010:chap 165.
22. Betahistine in the treatment of vertiginous syndromes: a meta-analysis. Della Pepa
C, Guidetti G, Eandi M.Department of Anatomy, Pharmacology and Forensic Medicine, University of Turin, Italy. Acta Otorhinolaryngol Ital. 2006 Aug;26(4):208-15.
23. Betahistine Treatment Improves the Recovery of Static Symptoms in Patients With Unilateral Vestibular Loss, J Clin Pharmacol 2011 51: 538, 12 October 2010
24. Neuhauser HK, Radtke A, von Brevern M, Lezius F, Feldmann M, Lempert T. Burden of
dizziness and vertigo in the community. Arch Intern Med. 2008;168(19):2118-2124
25. Handbook of Clinical Neurology, Vol. 137 (3rd series) Neuro-OtologyJ.M. Fur man and T. Lem per t , Editors http: //dx.d oi.org/10.1016/ B978-0-444-63437-5.00017-0 © 2016 Elsevier B.V.
26. Spiegle Rainer, Rust Helko, Bauman Thomas, Friedrich Hergen, and cols. University Hospital, University of Basel. Switzerland Treatment of Dizzines: an interdisciplinary update. Swiss Med Weekly. 2017;147:w14566
27. Michael Strupp, Marco Mandala, José Lopez-Escámez. Peripheral Vestibular discordes: an update. Bilateral Vestibulopathy www.co- neurology.com Volume 32, Number 1, February 2019
28. A. Tucker Gleason, PhD. Bradley W. Kesser. MD University of Virginia School of Medicine. Charlottesville. VA. USA. Dizzines and Vertigo Across Lifespan. Book.
Elsevier. 2018.
29. Hussain K, Murdin L, Schiller AGM. Restriction of salt, caffeine and alcohol for the treatment of Méniére’s disease or syndrome (Review). Cochrane Library. cochrane Database of Systematic Reviews 2018, Issue 12 Art. No: CD012173
30.Halmagy GM, Chen L, MacDougall HG and cols. The Video Head Impulse Test. Frontiers in Neurology. www.frontiersin.org June 2017 Volume 8 Art. 258
31. Alhabib SF, Saliba I, Video Head Impulse Test: a review of the literature. University of Montreal. Canada. Eur Arch. Otorhinolaringol. 2017 274:1215-1222.
32. Bhattacharyya N, Gubbels SP, Schwartz SR, Edlow J, and cols. Clinical Practice Guideline: Benign Paroxysmal Positional Vertigo (Update). Otolaryngology Head and
Neck Surgery 2017 Vol156 (35) S1-S47
33. Hussain K, Murdin L, Schiller AGM. Betahistine for Symptoms of vértigo (Review) Cochrane Library. Cochrane Database of Systematic Reviews 2016, Issue 6 Art. No: CD010696.
34. Use of betahistine in the treatment of peripheral vertigo. Acta Oto-Laryngologica
Volume 135, 2015 – Issue 12 Pages 1205-1211 Received 27 May 2015, Accepted 08 Jul 2015, Published online: 06 Aug 2015. Consenso Latinoamericano. Rubén Ramos Alcocer, José Gregorio Ledezma Rodríguez, Navas Romero, José Luis Cárdenas Núñez, Vicente Rodríguez Montoya, José Junior Deschamps & Jorge Anibal Liviac Ticse. Download citation http://dx.doi.org/10.3109/00016489.2015.1072873
35. In vitro equivalence evaluation of betahistine generic medicinal products as a tool potentially determining the efficacy of pharmacotherapy S.K. ZYRYANOV, O.I. BUTRANOVA, G.V. RAMENSKAYA, G.N. GILDEEVA, I.E. SHOHIN Peoples’ Friendship University of Russia,
Medical Institute, Department of General and Clinical Pharmacology. Moscow,
Russia; Sechenov First Moscow State Medical University (Sechenov University),
Moscow, Russia; Center of Pharmaceutical Analytic Ltd., Moscow, Russia ЖУРНАЛ
НЕВРОЛОГИИ И ПСИХИАТРИИ, 11, 2018 https://doi.org/10.17116/jnevro201811811143
Dr. Vicente Rodríguez Montoya
Otorrinolaringólogo – Otólogo-Médico Cirujano. Pontificia Universidad Javeriana
-Otorrinolaringólogo. Pontificia Universidad Javeriana Hospital Universitario San Ignacio – Fellow Otology-neurotology. University of Iowa, Iowa City, Iowa. USA
University of Iowa Hospitals and Clinics Department of Otolaryngology Head and
Neck Surgery.
ABC del vértigo
¿Cómo reconocerlo y evitar confundirlo con episodios de mareo?
- 1 de cada 10 personas en todo el mundo experimenta vértigo.
- Las técnicas de fisioterapia, los cambios en el estilo de vida y la medicación son maneras de tratar efectivamente esta afección.
El vértigo es uno de los síntomas principales de enfermedades del oído interno o del cerebro. Actualmente, se calcula que 1 de cada 10 personas lo experimenta. A pesar de su alta prevalencia, existe una falta de conciencia sobre el impacto que tiene en quienes lo padecen y es fácilmente confundido con “episodios de mareo”, ya que la principal sensación asociada con el vértigo es de movimiento o giro en el entorno, sin que realmente esté sucediendo. Las personas que sufren de vértigo ven afectado principalmente su sistema vestibular.
Este funciona como un GPS interno: proporciona información a través del oído interno y envía señales al cerebro para lograr realizar movimientos con normalidad y manteniendo el equilibrio. Este sistema permite, por ejemplo, utilizar ambos lados del cuerpo al mismo tiempo e indica la dirección de los movimientos.
En ese sentido, cuando las señales con información del oído se interrumpen, el vértigo se provoca. “Es difícil expresar con palabras exactas cómo se siente el vértigo, pero es un síntoma que debemos tomar en serio. Algunas personas afirman que se sienten alejadas al ver pasar un tren y otros señalan que es como caer estando de pie. Esta sensación puede ser leve o puede ser tan grave que le resulte difícil mantener el equilibrio y realizar tareas cotidianas.
Asimismo, a menudo se acompaña de visión borrosa o dificultad para concentrarse”, señala el Dr. Álvaro Rojas, director Médico de Abbott, quien ofrece seis claves para entender qué es y cómo funciona el vértigo:
- ¿QUÉ ES?
El vértigo es un síntoma, más que una condición en sí. Es importante comprender que el oído interno contiene dos estructuras: una encargada de la audición y otra que regula el equilibrio. Los movimientos de la cabeza hacen que se envíen señales desde el oído interno al sistema de equilibrio del cerebro, para que luego este ayude a mantener el equilibrio y la postura. Una falla en esta estructura causaría una sensación inexistente de movimiento.
2. ¿QUÉ LO CAUSA?
Entre sus principales orígenes están: cristales sueltos en el oído interno que hacen que ciertos movimientos de la cabeza lo provoquen; una infección de oído resultante de un resfriado o de un ataque de gripe; una inflamación viral del nervio vestibular; o un trastorno prolongado del oído interno que, en ocasiones, también implica zumbidos o pérdida de la audición.
3. ¿CUÁLES SON SUS DESENCADENANTES?
Existen distintos desencadenantes que activan el vértigo como las situaciones de mucho estrés; el alcohol debido a la deshidratación que genera; la falta de sueño; los alimentos con alto contenido de sal, azúcar o tiramina; y los movimientos de cabeza y cuerpo que se dan de forma rápida.
4. ¿CUÁNTO DURA?
Esta condición puede aparecer repentinamente y el tiempo de duración es relativo, podrían ser unos segundos o incluso varios días.
5. ¿QUÉ CONSECUENCIAS TRAE?
Considerando que el vértigo es una sensación que aparece de forma repentina, este puede ocasionar caídas y fracturas. Además, puede impactar negativamente en las interacciones sociales pues las personas que lo experimentan tienden a quedarse en casa y perder el contacto social, provocando pérdida de independencia, ansiedad y, en última instancia, depresión. Asimismo, el vértigo puede tener consecuencias en la vida laboral y las finanzas personales. Investigaciones han demostrado que la sensación del vértigo es responsable de que el 27% de las personas cambien de trabajo, el 21% deje de trabajar por completo, el 50% reduzca su eficiencia laboral y el 63% pierda jornadas laborales; situación que impacta directamente en sus finanzas y, por ende, en su bienestar general.
6. ¿CÓMO SE PUEDE TRATAR?
A menudo, el vértigo se puede tratar con éxito mediante un enfoque holístico que incorpore medicación, ejercicios físicos y otros factores como una alimentación saludable y adherencia al tratamiento. Lo más importante es acudir al médico si hay sospecha de vértigo para que se confirme si es y qué lo está causando. Una vez se aclare el panorama, se puede recomendar la mejor manera de tratarlo y brindar alivio a largo plazo.
“Actividades que la mayoría de las personas damos por sentado como viajar, trabajar o visitar amigos pueden resultar muy difíciles para las personas con vértigo. La buena noticia es que es completamente posible controlarlo y vivir una vida plena. Una vez haya un diagnóstico, los episodios de vértigo suelen ser tratables, por lo que buscar la atención adecuada puede ayudar a que las personas vuelvan a hacer lo sus actividades comunes”, agregó el director Médico de Abbott.
Referencias
1. Agrawal Y, Ward BK, Minor LB. Vestibular dysfunction: prevalence, impact and need for targeted treatment. J Vestib Res. 2013;23(3):113-117