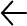Actualidad en la artritis reumatoide
Epidemiología, fisiopatogenia y diagnóstico
Introducción
La artritis reumatoide (AR) es la enfermedad reumática autoinmune de mayor prevalencia entre la población adulta a nivel mundial y tiene especial relevancia porque ejerce un significativo impacto adverso sobre el bienestar general, la calidad de vida, la funcionalidad y la productividad de los individuos afectados, a la vez que está asociada a mortalidad prematura; por ende, impone una carga económica sustancial sobre los pacientes, los sistemas de atención en salud y la sociedad general.1-10
La artritis reumatoide es una poliartritis inflamatoria simétrica de las pequeñas articulaciones, de curso crónico y progresivo, caracterizada principalmente por la inflamación e hiperplasia sinoviales resultantes de la infiltración articular por células inmunes reactivas, la destrucción del cartílago articular, la erosión ósea, el compromiso poliarticular, el desarrollo de complicaciones sistémicas (de tipo cardiovascular, pulmonar, hematológico, cutáneo y esquelético), y sobre todo, la producción de autoanticuerpos, de los cuales, los de mayor relevancia clínica incluyen al factor reumatoide (FR), el cual se identifica en 69% a 90% de los pacientes, y los anticuerpos antiproteínas modificadas postraduccionalmente (AMPAs), que incluyen entre otros a los anticuerpos antiproteína citrulinada (ACPAs).1-4,6-9,11-15
En la artritis reumatoide se ha identificado una amplia variedad de AMPAs, contra proteínas modificadas por otros procesos postraduccionales diferentes a la citrulinación, tales como la carbamilación y la acetilación. Mientras que los ACPAs están presentes en 50% a 80% de los pacientes y pueden detectarse hasta una década antes del inicio de los síntomas de la enfermedad, en alrededor de 45% se identifican autoanticuerpos antiproteína carbamilada (anti-CarP), los cuales son detectables aún más tempranamente y están asociados a un mayor grado de destrucción articular con el tiempo. De otra parte, alrededor de 30% a 40% de los pacientes exhiben autoanticuerpos antiproteína acetilada, 35% tienen autoanticuerpos anti-PAD4 y 21% a 32% presentan autoanticuerpos anti-bRAF y anti-RA33.2,3,5,12-17
La presencia de FR y/o de AMPAs (especialmente de ACPAs) define a la artritis reumatoide seropositiva y ello ocurre en alrededor de 50% de los individuos con artritis reumatoide temprana, así como en 80% de aquellos con enfermedad establecida, pero en el porcentaje restante no se identifican dichos autoanticuerpos, de modo que tales pacientes corresponden a la artritis reumatoide seronegativa. Aunque los datos acumulados indican que la artritis reumatoide seropositiva y la seronegativa son dos entidades separadas, asociadas entre otros aspectos a determinantes genéticos y factores de riesgo específicos diferentes, así como a distintos patrones de evolución/progresión, las guías de manejo vigentes no hacen distinción entre ellas en cuanto al abordaje terapéutico inicial.1-5,12-18 Teniendo en cuenta la naturaleza progresiva del deterioro articular, el diagnóstico temprano de la artritis reumatoide es una cuestión fundamental, ya que permite la instauración oportuna de medidas terapéuticas encaminadas a frenar dicha progresión, centradas en la administración de fármacos antirreumáticos modificadores de la enfermedad (DMARDs) y de esta manera previene tanto el desarrollo de daño severo e irreversible de las articulaciones comprometidas como la discapacidad asociada a este, con la subsiguiente reducción de la carga socioeconómica de la enfermedad. En tal sentido, la evidencia acumulada hasta la fecha indica que en los dos años posteriores al inicio de la enfermedad puede ocurrir una considerable destrucción articular (que suele ser permanente) y, por lo tanto, es esencial el manejo óptimo de la enfermedad durante este periodo crítico, sobre todo en los primeros tres a seis meses siguientes al inicio de la sintomatología.1-3,6,9-12,15,19,20
Epidemiología y factores de riesgo
Durante las últimas tres décadas la prevalencia global de la artritis reumatoide ha aumentado de manera sostenida, al punto que según estimativos recientes, en la actualidad afecta a alrededor de 1% de la población mundial (rango: 0,4% a 2%), siendo una de las enfermedades inflamatorias crónicas de mayor prevalencia entre los adultos. De acuerdo con una extensa revisión sistemática de estudios poblacionales, la prevalencia puntual promedio de artritis reumatoide entre la población adulta mundial es de 0,56% (rango: 0%- 2,7%), mientras que según el más reciente Global Burden of Disease Study, la prevalencia global estandarizada por edad fue de 224.25 casos por 100.000 habitantes (rango: 204.94 – 245.99) y la artritis reumatoide estuvo asociada a 3’060.000 años de vida con discapacidad, para una tasa ajustada por edad de años de vida con discapacidad de 36,4 por 100.000 personas (rango: 27,6-45,9 por 100.000); además, en una revisión sistemática, la prevalencia reportada de esta entidad entre la población de los países de bajos-medianos ingresos de la región de las Américas fue de 1,25%, mientras que la prevalencia estimada en Colombia varía de 0,52% a 1,49%.1,3,5,6,8-11,14-16,21
Los reportes epidemiológicos indican, consistentemente, que esta entidad es dos a tres veces más prevalente en las mujeres que en los hombres, con un riesgo durante la vida de 3,6% para ellas y de 1,7% entre los varones, y exhibe una frecuencia creciente de presentación a medida que aumenta la edad, con un pico máximo de incidencia entre los 65 y 80 años.1-4,8,14,15
La artritis reumatoide es una entidad multifactorial, que involucra la participación de factores genéticos, epigenéticos, ambientales y estocásticos (Figura 1). Mientras que en la enfermedad seropositiva los factores genéticos desempeñan un prominente papel etiopatogénico (ya que la heredabilidad es de hasta 65%), en el desarrollo de la artritis reumatoide seronegativa la susceptibilidad genética es, comparativamente, menos relevante (heredabilidad de 20%) y son los factores ambientales los que tienen especial relevancia. Ahora bien, de los factores ambientales vinculados al riesgo de desarrollar artritis reumatoide el más relevante es el tabaquismo, en tanto que otros factores menos significativos comprenden la exposición a sílice, asbesto o polvo de textiles, así como la colonización de la mucosa oral por Porphyromonas gingivalis, la disbiosis intestinal (en particular la disminución de la diversidad del microbioma) y la obesidad.1-4,12-18,22
Por su parte, los estudios de asociación genómica amplia (GWA) con polimorfismos de nucleótido único indican que más de 100 sitios cromosómicos específicos están vinculados a la susceptibilidad genética para la artritis reumatoide y la mayoría de ellos incluyen variantes de genes relacionados con la inducción, regulación y preservación de las respuestas inmunes, tales como los del antígeno leucocitario humano de clase II (HLA), que codifican moléculas del complejo mayor de histocompatibilidad; sin embargo, los principales genes vinculados al desarrollo de la enfermedad varían dependiendo de la presencia o ausencia de FR y ACPAs. En este sentido, los estudios genéticos han demostrado la asociación entre la artritis reumatoide seropositiva y ciertas anomalías genéticas que involucran, entre otros, a los genes HLA-DRB1, HLADRB4, PAD14, PTPN22, CTLA4, IL-2RA y STAT4 (Tabla 1), siendo especialmente alto el riesgo de artritis reumatoide ACPA+ en los individuos que presentan los alelos HLA-DRB1*04, HLA-DRB1*01 y HLA-DRB1*10, así como ciertos alelos de los genes PTPN22 (que codifica para la proteína tirosina fosfatasa no receptora tipo 22, PTPN22), TRAF1 y C5; estos dos últimos genes codifican, respectivamente, para el factor 1 asociado al receptor del factor de necrosis tumoral y para el componente 5 del complemento.1-4,12-15,17,18,20
Figura 1. Factores contribuyentes al desarrollo de artritis reumatoide, de tipo genético-epigenético, ambiental y estocástico (lesión sinovial, infección articular).1-4,12,13,15,17
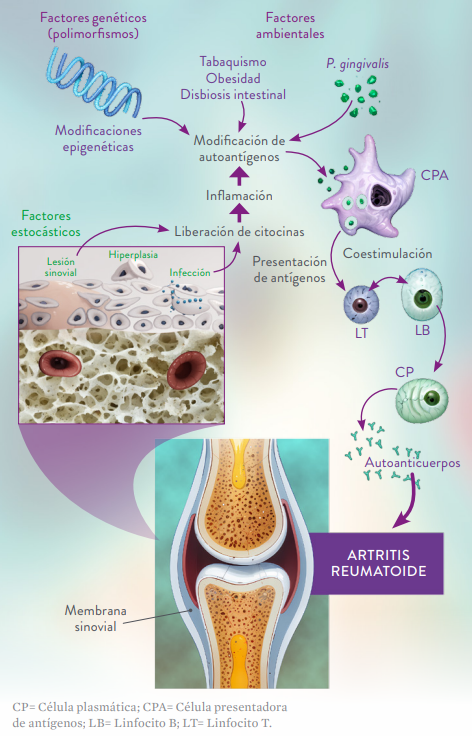
Tabla 1. Principales genes vinculados a la artritis reumatoide seropositiva.2,15,21
Aspectos fisiopatogénicos
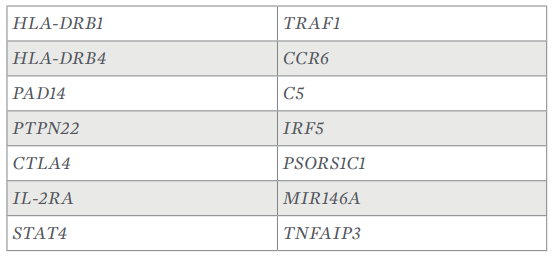
Hasta la fecha no se conoce por completo la fisiopatogenia exacta de la artritis reumatoide, pero se considera que involucra la activación de una respuesta autoinmune en la que participan numerosas células efectoras y múltiples mediadores inflamatorios, a partir de la generación durante la denominada fase pre-artritis reumatoide de diversos autoantígenos; dichos autoantígenos, una vez modificados por diversos procesos postraduccionales, tanto enzimáticos como no enzimáticos (citrulinación, carbamilación, acetilación y otros), son captados por las células dendríticas y presentados a los linfocitos T y B, lo que desencadena la síntesis de autoanticuerpos específicos. En etapas ulteriores de la enfermedad el tejido sinovial es infiltrado por células inmunes, principalmente linfocitos T, linfocitos B y macrófagos, los cuales una vez activados liberan diversas citocinas proinflamatorias y quimocinas; de hecho, la inflamación articular es iniciada y mantenida por complejas interacciones entre los distintos subtipos de células dendríticas, los linfocitos T, los macrófagos, los linfocitos B, los neutrófilos, los fibroblastos y los osteoclastos (Figura 2) y en esta secuencia de eventos los linfocitos B desempeñan un papel fisio[1]patológico muy importante pues intervienen en múltiples procesos que contribuyen a amplificar y mantener la respuesta inflamatoria en el tejido sinovial. Así, los linfocitos B no solo liberan citocinas proinflamatorias (CCL3, TNF-α, IFN-γ, linfotoxina-β, etc.) y quimocinas promotoras de la migración de linfocitos T y células dendríticas, sino que al actuar como células presentadoras de antígenos inducen una prominente activación de los linfocitos T CD4+ ayudado[1]res, mientras que al diferenciarse en células plasmáticas, generan grandes cantidades de autoanticuerpos, los cuales forman complejos inmunes que, entre otros mecanismos, promueven la activación local del complemento, lo que lleva a la producción de C5a y complejos de ataque de membrana, que acentúan el daño tisular.1-5,8,12-17,22-25
Figura 2. Esquema condensado de la fisiopatología de la artritis reumatoide, que ilustra los mecanismos dependientes de las distintas células involucradas.1-5,8,12,15,23-2
Diagnóstico: Conceptos esenciales
La presentación clínica típica de la artritis reumatoide es la poliartritis simétrica, caracterizada por dolor, edema y rigidez articula[1]res; si bien la enfermedad puede afectar a cualquier articulación sinovial, casi siempre el compromiso inicial involucra a las pequeñas articulaciones distales de las manos y los pies. Por lo menos 40% de los pacientes presentan complicaciones sistémicas extraarticulares y la incidencia estimada de complicaciones extraarticulares serias es de 8,3%, siendo las más frecuentes la enfermedad cardio[1]vascular, la enfermedad pulmonar intersticial, la osteoporosis y el síndrome metabólico. En ausencia de tratamiento el daño articular empeora de manera gradual hasta la deformidad irreversible, ocasionando dolor persistente y discapacidad progresiva, a la vez que las manifestaciones sistémicas se hacen más prominentes y graves, con el subsiguiente incremento de la mortalidad prematura.1-5,8-11,13,19
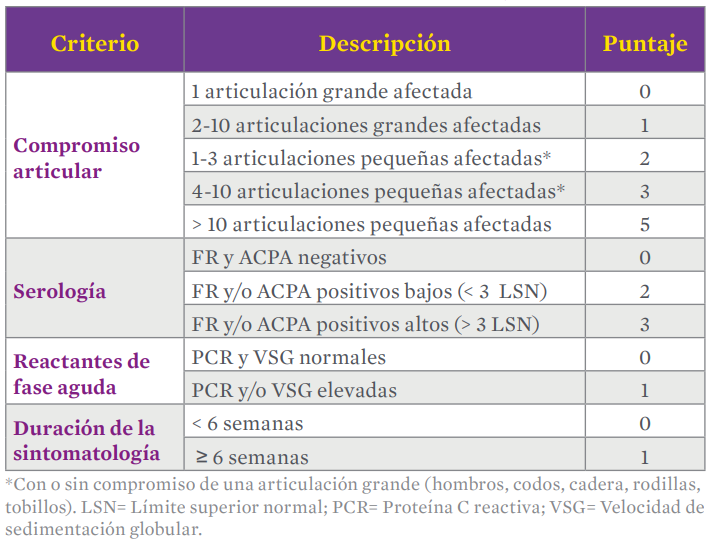
El diagnóstico de la artritis reumatoide está basado en el juicio clínico y los criterios de clasificación establecidos por el Colegio Americano de Reumatología y la Liga Europea Contra el Reumatismo (ACR-EU[1]LAR) que asignan distintos puntajes a ciertos parámetros como el compromiso articular o la duración de la sintomatología (Tabla 2), de tal manera que una puntuación total ≥ 6 permite establecer el diagnóstico definitivo de artritis reumatoide, teniendo en cuenta que la sensibilidad diagnóstica de estos criterios es de 82% y su especificidad de 61%. Por su parte, los biomarcadores usualmente utilizados con fines diagnósticos son el FR y los ACPAs, y en menor proporción los anti-CarP; si bien el FR y los ACPAs están presentes en la mayoría de pacientes, la especificidad del FR para el diagnóstico de la enfermedad es de 60% a 85% y su sensibilidad es de 69%, mientras que los ACPAs tienen una sensibilidad diagnóstica de 67%, con una especificidad de 85%-99. Ahora bien, en los pacientes seronegativos para FR o ACPAs pero con firme sospecha clínica de la enfermedad, puede efectuarse como estudio diagnóstico alternativo la determinación de anticuerpos anti vimentina citrulinada mutante (anti-MCV).1-4,14,19,26,27
Para la confirmación de artritis reumatoide, el abordaje óptimo consiste en utilizar el diagnóstico diferencial (con entidades tales como el síndrome de Sjögren, la osteartritis, la espondiloartritis y la artritis psoriásica, entre otras), pero es un proceso difícil y a menudo requiere de la realización de biopsia y estudios diagnósticos adicionales. Una vez confirmado el diagnóstico, el paso a seguir es la evaluación de la actividad de la enfermedad y para ellos están disponibles numerosas herramientas validadas; según las recomendaciones actualizadas del Colegio Americano de Reumatología, las más apropiadas son: DAS28- ESR/CRP, CDAI, SDAI RAPID3 y PAS-II.1-3,7,11,19,27,28
Tabla 2. Criterios de clasificación y diagnóstico de la artritis reumatoide, establecidos por el Colegio Americano de Reumatología y la Liga Europea contra el Reumatismo (ACR/EULAR).1-4
Conclusiones:
La relevancia clínica de la artritis reumatoide obedece, principalmente, a las implicaciones adversas de la progresión de esta entidad sobre el bienestar general, la funcionalidad, la productividad y la calidad de vida de los individuos afectados. Por consiguiente, es crucial el diagnóstico temprano y la instauración inmediata de estrategias terapéuticas dirigidas a frenar tanto el deterioro de las articulaciones comprometidas como el desarrollo de complicaciones extraarticulares.1-10,12,15,19,20
Referencias
1. Radu AF, Bungau SG. Management of rheumatoid arthritis: an overview. Cells 2021; 10: 2857-90.
2. Chauhan K, Jandu JS, Brendt LH, Al-Dhahir MA. Rheumatoid arthritis. StatPearls (Internet); Treasure Island (FL): StatPearls Publishing 2023; 28723028.
3. Lin YJ, Anzaghe M, Schülke S. Update on the pathomechanism, diagnosis, and treatment options for rheumatoid arthritis. Cells 2020; 9: 880-922.
4. Jang S, Kwon EJ, Lee JJ. Rheumatoid arthritis: pathogenic roles of diverse immune cells. Int J Mol Sci 2022; 23: 905-19.
5. Bhamidipati K, Wai K. Precision medicine in rheumatoid arthritis. Best Pract Res Clin Rheumatol 2022; 36: 101742.
6. Cai Y, Zhang J, Liang J, et al. The burden of rheumatoid arthritis: findings from the 2019 Global Burden of Diseases Study and forecast for 2030 by Bayesian Age-period-cohort analysis. J Clin Med 2023; 12: 1291-301.
7. Conley B, Bunzli S, Bullen J, et al. What are the core recommendations for rheumatoid arthritis care? Systematic review of clinical practice guidelines. Clin Rheumatol 2023; 42: 2267-78.
8. Wu D, Luo Y, Li T, et al. Systemic complications of rheumatoid arthritis: focus on pathogenesis and treatment. Front Immunol 2022; 13: 1051082.
9. Black RJ, Cross M, Hatle LM, et al; GBD 2021 Rheumatoid Arthritis Collaborators. Global, regional, and national burden of rheumatoid arthritis, 1990-2020, and projections to 2050: a systematic analysis of the Global Burden of Disease Study 2021. Lancet Rheumatol 2023; 5: e594-610.
10. Zou W, Fang Y, Xu D, Zhu Y. Increasing global burden of rheumatoid arthritis: an epidemiological analysis from 1990 to 2019. Arch Med Sci 2023; 19: 1037-48.
11. Pisetsky DS. Advances in the treatment of rheumatoid arthritis: costs and challenges. N C Med J 2017; 78: 337-40.
12. Mueller AL, Payandeh Z, Mohammadkhani N, et al. Recent advances in understanding the pathogenesis of rheumatoid arthritis: new treatment strategies. Cells 2021; 10: 3017-55.
13. Scherer HU, Häupl T, Burmester GR. The etiology of rheumatoid arthritis. J Autoimmun 2020; 110: 102400.
14. Van Delft MAM, Huizinga TWJ. An overview of autoantibodies in rheumatoid arthritis. J Autoimmun 2020; 110: 102392.
15. Karmakar U, Vermeten S. Crosstalk between B cells and neutrophils in rheumatoid arthritis. Immunology 2021; 164: 689-700.
16. Volkov M, van Schie KA, van der Woude D. Autoantibodies and B cells: the ABC or rheumatoid arthritis pathophysiology. Immunol Rev 2020; 294: 148-63.
17. Kronzer VL, Davis JM. Etiologies of rheumatoid arthritis: update on mucosal, genetic, and cellular pathogenesis. Curr Rheumatol Rep 2021; 23: 21-30.
18. De Stefano L, D’Onofrio B, Gandolfo S, et al. Seronegative rheumatoid arthritis: one year in review 2023. Clin Exp Rheumatol 2023; 41: 554-64.
19. Toro-Gutiérrez CE, Arbeláez A, Fernández AR, y cols. Guía de práctica clínica para la detección temprana, el diagnóstico, el tratamiento y el seguimiento de los pacientes con artritis reumatoide. Asociación Colombiana de Reumatología, 2022. Rev Colomb Reumatol 2023; https://doi.org/10.1016/j.rcreu.2023.02.001.
20. Fraenkel L, Bathon JM; England BR, et al. 2021 American College of Rheumatology guidelines for the treatment of rheumatoid arthritis. Arthritis Care Res 2021; 73: 924-39.
21.Rudan I, Sidhu SS, Papana A et al. Prevalence of rheumatoid arthritis in low-and middle income countries: a systematic review and analysis. J Glob Health 2015; 5: 010409.
22. Giannini D, Antonucci M, Petrelli F, et al. One year in review 2020: pathogenesis of rheumatoid arthritis. Clin Exp Rheumatol 2020; 38: 387-97.
23. Takeuchi T. Treatment of rheumatoid arthritis with biological agents – as a typical and common immune-mediated inflammatory disease. Proc Jpn Acad Ser B Phys Biol Sci 2017; 93: 600-8.
24. Wu F, Gao J, Kang J, et al. B cells in rheumatoid arthritis: pathogenic mechanisms and treatment prospects. Front Immunol 2021; 12: 750753.
25. Zhu M, Ding Q, Lin Z, et al. New targets and strategies for rheumatoid arthritis: from signal transduction to epigenetic aspect. Biomolecules 2023; 13: 766-85.
26. Taylor P. Update on the diagnosis and management of early rheumatoid arthritis. Clin Med 2020; 20: 561-4.
27. Atzeni F, Talotta R, Masala IF, et al. Biomarkers in rheumatoid arthritis. Isr Med Assoc J 2017; 19: 512-6.
28. England BR, Tiong BK, Bergman MJ, et al. 2019 Update of the American College of Rheumatology recommended rheumatoid arthritis disease activity measures. J Arthritis Care Res 2019; 71: 1540-55